题目内容
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
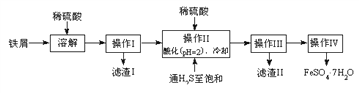
查询资料,得有关物质的数据如下表:
25℃时 | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 |
pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为____________________。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是(写两点)___________、____________。
(3)操作IV的顺序依次为________、冷却结晶、过滤。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为_________(填仪器名称)。
②计算上述样品中FeSO47H2O的质量分数为__________。
③上述测定中,若滴定管规格为50mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数)
【答案】 A 除去溶液中的Sn2+离子 将Fe3+还原成Fe2+ 蒸发浓缩 酸式滴定管 75% 9.3000
【解析】(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法:,Fe3+和SCN-会反应生成红色的Fe(SCN)3,从而证明了Fe3+的存在。所以答案为A选项。
(2)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以将Fe3+还原为Fe2+。将H2S在溶液中饱和,可以增大溶液中的S2-浓度,尽量保证将Sn2+转化为SnS沉淀,以便于过滤除去Sn杂质。故答案为:除去溶液中的Sn2+离子,并将Fe3+还原成Fe2+。
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,冷却结晶,过滤,洗涤,干燥等,所以操作IV的顺序依次为:蒸发浓缩,冷却结晶,过滤。故答案为:蒸发浓缩。
(4)①高锰酸钾溶液具有强氧化性,所以会氧化碱式滴定管尖嘴处的橡胶管,所以滴定时盛放KMnO4溶液的仪器为酸式滴定管。
②用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL,则根据方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O得到:n(Fe2+)=0.01000mol/L×0.0200L×5=0.001mol。所以250mL溶液中有n(Fe2+)=0.01mol。则FeSO47H2O物质的量也是0.01mol,质量为0.01mol×278g/mol=2.78g,质量分数为:2.78g÷3.72g=![]() =74.73%=75%。
=74.73%=75%。
③若滴定管规格为50mL,则最多盛放50mL的高锰酸钾溶液,根据方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O得到最多反应的n(Fe2+)=0.01000mol/L×0.0500L×5=0.0025mol,所以250mL溶液中有n(Fe2+)=0.025mol,则FeSO47H2O物质的量最多是0.025mol,质量为0.025mol×278g/mol=6.95g,因为样品中FeSO47H2O的质量分数为![]() ,所以样品质量为6.95÷
,所以样品质量为6.95÷![]() =9.3g,题目要求保留4位小数,所以为9.3000g。
=9.3g,题目要求保留4位小数,所以为9.3000g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案