题目内容
将一定量的PH3和H2的混合气体,依次通过两支加热的硬质玻璃管,第一支装有足量的铜屑,第二支装有足量的CuO。第一支玻璃管中因发生反应:2PH3+3Cu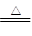 Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。
Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。
试求:原混合气体中PH3与H2的体积比。
4∶3
解析试题分析:设原混合气体中PH3、H2的物质的量分别为x,y,第一支玻璃管中生成H2的物质的量为z,则
2PH3+3Cu Cu3P2+3H2 反应前后固体增加的质量Δm
Cu3P2+3H2 反应前后固体增加的质量Δm
2 mol 3 mol (64×3+31×2-64×3)="62" g
x z 4.96 g
解得x=0.16 mol,z=0.24 mol。
CuO+H2 Cu+H2O 反应前后固体减轻的质量Δm
Cu+H2O 反应前后固体减轻的质量Δm
1 mol (64+16 )-64="16" g
(y+0.24)mol 5.76 g
解得y=0.12 mol。
对气体来说,同温同压下气体的体积比等于它们物质量的比。所以原混合气体中PH3和H2的体积比为:0.16:0.12=4:3
考点:考查差量法在化学计算中的应用的知识。

 名校课堂系列答案
名校课堂系列答案(1)900 K时,用足量的H2与钠钾合金10.10 g充分反应,得到10.40g白色的氢化物混合物,则该钠钾合金的化学式为____________。
(2)将l.56 g Na2O2加入20.00g水中,充分反应后,所得溶液的质量分数为________(保留3位小数,用百分数表示保留l位小数);25℃时NaOH的溶解度为53.00 g/100g水,则将该溶液蒸发_______g水后恢复至25℃可得饱和溶液(保留2位小数)。
(3)取10.00 gNaNO3加热,得到的固体中Na的质量分数为31.51%,则氧的质量分数为_________(保留2位小数)。
(4)某碱金属R与汞的合金2.4g加入足量水中,充分反应后,收集到气体l.12 L(标准状况),则可推导出R元素是________(写元素符号)。
(5)在l.12 L密闭容器中,将KOH与O3在一定条件下反应,得到气体(只含一种元素)、固体物质A和KOH·H2O。有关实验数据如下:
| KOH | O3 | A | KOH·H2O | 气体密度 |
| 16.8 g | 0.3 mol | a g | b g | >1.429 g/L |
| 16.8 g | 0.2 mol | a g | b g | 1.429 g/L |
A会缓慢分解产生一种钾的氧化物和O2。试确定A的化学式: 。
今年暑假里学校化学实验室装修,药品被转移到了安全的场所保管,但是因为工作人员的疏忽,有几瓶氢氧化钠没有及时转移,开学后才发现,现在需要测定氢氧化钠是否有变质,变成了什么。所以某兴趣小组接下了任务,他们是这么做的:常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,反应过程中没有观察到气泡,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| | 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③数据可靠。通过计算,分析和比较上表3组数据,给出结论。
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,假设反应的还原产物只有NO,若实验中生成的NO气体体积及所得剩余固体的质量记录如下(所有体积均在标准状况下测定):
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液体积 | 100 mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8 .0g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72 L | 7.84 L | 7.84 L |
(2)每一等份的混合物粉末中铜的质量。
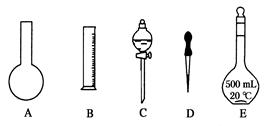
用18.4mol·L-1的浓H2SO4配制100mL浓度为1mol·L-1的H2SO4溶液,其操作可分为以下各步:
| A.用量筒取 mL浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌 |
| B.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液都倒入100mL容量瓶里 |
| C.将稀释后H2SO4溶液小心倒入100mL容量瓶里 |
| D.检查100mL容量瓶口部是否会发生滴漏 |
(F)盖紧瓶塞,反复颠倒振荡,摇匀溶液
(G)用 向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切
据此填写:(1)上述各步的空白处。
(2)正确的操作顺序是(字母填写) 。
(3)进行A步操作应选择下列量器:①10mL量筒;②50mL量筒;500mL量筒;④1000mL量筒中的(填序号) 。