题目内容
(1)NA为阿伏加德罗常数。25℃时,1g水中含H+离子个数约为__________NA。
(2)通过氨的催化氧化法制取硝酸,在此全过程中,理论上氨与所耗氧气的物质的量比为__________,这样所得硝酸的质量分数为_____________。
(3)往含0.2 mol NaOH和0.1 mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5 mol。请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图。(不计弱电解质的电离和盐的水解)
(4)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为0.4, 480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)
(1)10-10 (2分)
(2)1:2 0.778 (4分)
(3)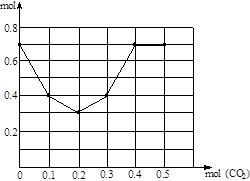
(0,0.7) (0.1,0.4) (0.2,0.3) (0.3,0.4) (0.4,0.7) (0.5,0.7) (5分)
(4)(4分)解 m(Cu) = 480×0.4=192g m(CuO)=480g-192g=288g
n(Cu) =192/64=3mol, n(CuO) = 288/80=3.6mol (1分)
n(Cu) +n(CuO)="3mol" +3.6mol = 6.6mol
由Cu守恒得: n(H2SO4)=n(CuSO4·5H2O)=6.6mol(1分)
m(CuSO4·5H2O)=6.6mol×250g/mol=1650g
设HNO3为xmol ,由得失电子数相同得: 2×480×0.4/64=3x x=2
n(HNO3) ="2mol" 则放出NO为2mol,质量为2×30=60g(1分)
根据质量守恒:m(溶液)=1650+2×30-480=1230g(1分)
所以,H2SO4%=6.6×98/12300×100%=52.6%(1分)
解析试题分析:(1)水电离出的C(H+)=1.0×10-7mol?L?1, 1g水中含H+为:1g÷1000g/L×1.0×10-7mol?L?1=10-10mol。
(2)氨的催化氧化法制取硝酸发生如下反应:4NH3+5O2 4NO+6H2O、4NO+3O2+2H2O=4HNO3,所以氨与所耗氧气的物质的量比为:1:2;根据化学方程式可以看出:生成4molHNO3,最终得4molH2O,所得硝酸的质量分数=4mol×63g/mol÷(4mol×63g/mol+4mol×18g/mol)= 0.778。
4NO+6H2O、4NO+3O2+2H2O=4HNO3,所以氨与所耗氧气的物质的量比为:1:2;根据化学方程式可以看出:生成4molHNO3,最终得4molH2O,所得硝酸的质量分数=4mol×63g/mol÷(4mol×63g/mol+4mol×18g/mol)= 0.778。
(3)通入CO2前,0.2 mol NaOH和0.1 mol Ca(OH)2的混合溶液共含离子0.7mol,折线起点坐标(0,0.7),通入CO2首先发生反应:CO2+Ca2++2OH?=CaCO3↓+H2O,完全反应消耗0.1molCO2,减少0.3mol离子,得转折点坐标(0.1,0.4),继续通入CO2,发生第2步反应:CO2+2OH?=CO32?+H2O ,本步反应消耗CO2 0.1mol,离子减少0.1mol,得第2个转折点(0.2,0.3),第3步反应:CO2+CO32?+H2O=2HCO3?,消耗CO2 0.1mol,离子增加0.1mol,得第3个转折点(0.3,0.4),第4步反应:CO2+CaCO3+H2O=Ca2++2HCO3?,消耗CO2 0.1mol,离子增加0.3mol,得第4个转折点(0.4,0.7),因为不计弱电解质的电离和盐的水解,再通入CO2,离子浓度不变,得终点(0.5,0.7),连接各点得转折线。
(4)硫酸的质量根据元素守恒求算,n(H2SO4)=n(CuSO4·5H2O)="n(Cu)+n(CuO)," 题目已给条件:固体混合物的总质量为480 g,铜屑的质量分数为0.4,分别求出Cu、CuO的质量,进而求出物质的量;混酸溶液的质量根据质量守恒定律求算,反应前固体混合物的质量+混酸溶液的质量=反应后CuSO4·5H2O的质量+NO的质量,最后可求出H2SO4的质量分数。
考点:本题考查了化学计算和通过计算绘制图像。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案某厂平均每天产生约600 m3废氨水(NH3的浓度为153 mg·L-1,密度为1 g·cm—3。
(1)该废氨水中氨的物质的量浓度为 。
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3 的浓度降为17 mg·L-1。忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为 。(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。
①为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2 →2N2+6H2O。将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1∶10,试求参加主反应的氨占原料氨的体积百分含量。
(4)废氨水可用于脱除烟气中的SO2。氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物。现称取不同质量的混合物进行实验,结果如下:
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
试计算生成氨气的质量最大时样品的质量。
过碳酸钠俗称固体双氧水,是一种很好的消毒剂和供氧剂,化学式可表示为aNa2CO3·bH2O2,它具有Na2CO3和H2O2的双重性质。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量的MnO2粉末,充分反应后生成672 mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100 mL溶液A。现向三份体积为10 mL、浓度为c的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
请回答下列问题:
(1)用化学方程式表示向过碳酸钠溶液中加入MnO2粉末时放出气体的原因:_______________________________________________________________。
(2)稀硫酸的物质的量浓度c=________ mol·L-1。
(3)通过计算可确定过碳酸钠的化学式为________。
(4)工业上常以所含活性氧的质量分数
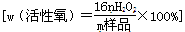 来衡量过碳酸钠产品的优劣,13%以上者为优等品。
来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2 g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0 mL 1 mol·L-1硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1 mol·L-1 Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00 mL,请通过计算判断该样品是否为优等品(要求写出计算过程)。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
某一种胃药中的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液
②取一粒(药片质量相同)0.2 g的此胃药片,磨碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,用去V mL达滴定终点
④加入25 mL 0.1 mol·L-1的HCl溶液
(1)写出实验过程的步骤(写编号顺序) 。
(2)下图所示容器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是 (填仪器名称)。 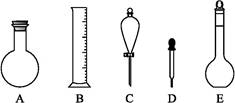
(3)配制上述溶液应选用的容量瓶规格是(填字母) 。
| A.50 mL 50 mL |
| B.100 mL 100 mL |
| C.100 mL 150 mL |
| D.250 mL 250 mL |
(5)每粒胃药中含碳酸钙的质量为 g。
分类是化学研究的重要方法之一,下列有关说法中,正确的是
| A.SO2、NO2、和CO2都属于酸性氧化物 |
| B.甲烷和和一氯甲烷都属于烷烃 |
| C.HC1O是弱电解质,NaClO却属于强电解质 |
| D.在水溶液中能电离出H+的化合物都属于酸 |
 2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为_____。
2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为_____。 Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。
Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。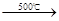 Na2SO4+2HCl↑
Na2SO4+2HCl↑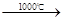 Na2S+2CO2↑
Na2S+2CO2↑