题目内容
试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为 。
(2)下图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为 mol/L。
②若实验室配制450mL1.19 mol/L的稀盐酸,需用该浓盐酸________ mL,如下图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是_______________(填仪器名称)。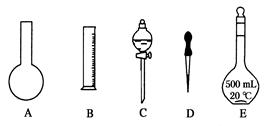
在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度____1.19mol/L (填“大于”“等于”或“小于”,下同)。若盐酸溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_______1.19mol/L。
(1)80g/mol (2分) (2) ①11.9 (2分) ②50 (2分) A、C (2分)
烧杯、玻璃棒(2分) 小于(1分) 小于(1分)
解析试题分析:(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则根据质量守恒定律可知,C的质量=24g+40g-32g=32g,所以C的摩尔质量=32g÷0.4mol=80g/mol。
(2)①根据c=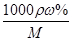 可知,该盐酸的浓度c=
可知,该盐酸的浓度c=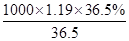 mol/L=11.9mol/L。
mol/L=11.9mol/L。
②由于实验室中没有450ml容量瓶,所以要配制450mL1.19 mol/L的稀盐酸,需用500ml容量瓶,则该浓盐酸的体积是V=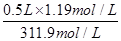 =0.05L=50ml。配制一定物质的量浓度溶液时需要的仪器主要是量筒、容量瓶、烧杯、玻璃棒以及胶头滴管,因此烧瓶和分液漏斗不需要,答案选AC。还缺少的仪器是烧杯和玻璃棒。若定容时仰视刻度线,则容量瓶中溶液的体积偏多,因此所得溶液浓度小于1.19mol/L;若盐酸溶液在转移至容量瓶时,洒落了少许,则溶质减少,因此所得溶液浓度小于1.19mol/L。
=0.05L=50ml。配制一定物质的量浓度溶液时需要的仪器主要是量筒、容量瓶、烧杯、玻璃棒以及胶头滴管,因此烧瓶和分液漏斗不需要,答案选AC。还缺少的仪器是烧杯和玻璃棒。若定容时仰视刻度线,则容量瓶中溶液的体积偏多,因此所得溶液浓度小于1.19mol/L;若盐酸溶液在转移至容量瓶时,洒落了少许,则溶质减少,因此所得溶液浓度小于1.19mol/L。
考点:考查物质的量以及物质的量浓度的有关计算、溶液配制、仪器选择和误差分析等

 阅读快车系列答案
阅读快车系列答案实验室中需要配制500 mL 0.10 mol·L-1的NaOH溶液,就该实验回答下列问题。
(1)用托盘天平称量NaOH固态 g。称量NaOH固体需注意以下两个问题:①因为NaOH具有腐蚀性,所以称量时,应选用 盛装NaOH固体;②称量必须迅速,目的是防止 。
(2)实验所需要的仪器除托盘天平、药匙外,还需要的玻璃仪器有: 、 、 、 。
(3)下列操作对所配制的溶液浓度没有影响的是 。
| A.定容时仰视刻度线 |
| B.将烧杯中溶解后的溶液立刻注入容量瓶,然后再添加蒸馏水至刻度线 |
| C.摇匀定容后,用胶头滴管向容量瓶中滴加蒸馏水至刻度线 |
| D.配制溶液前用蒸馏水润洗容量瓶 |
 CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
 2Fe(s) +3CO(g);
2Fe(s) +3CO(g); 2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为_____。
2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为_____。 Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。
Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。