题目内容
现有3个体积相等的密闭容器,都进行下列反应:CO2(g) + H2(g) H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2)=n(H2)=1 mol;乙:n(CO2)=1 mol, n(H2)=2mol;丙:n(CO2)=n(H2)=1mol n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是( )
H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2)=n(H2)=1 mol;乙:n(CO2)=1 mol, n(H2)=2mol;丙:n(CO2)=n(H2)=1mol n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是( )
 H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2)=n(H2)=1 mol;乙:n(CO2)=1 mol, n(H2)=2mol;丙:n(CO2)=n(H2)=1mol n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是( )
H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2)=n(H2)=1 mol;乙:n(CO2)=1 mol, n(H2)=2mol;丙:n(CO2)=n(H2)=1mol n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是( )| A.乙>甲>丙 | B.甲>丙>乙 | C.乙>丙>甲 | D.甲>乙>丙 |
A
试题分析:
CO2(g) + H2(g)
 H2O(g) + CO(g)
H2O(g) + CO(g)甲 1 1
乙 1 2
丙 1 1 1
以甲为参照对比,乙相当于在甲的基础上又加入了1mol的氢气,平衡向正向移动。所以平衡后CO的物质的量乙大于甲;丙相当于在甲的基础上又加入了1mol水,平衡向逆向移动,所以平衡后CO的物质的量的小于甲的;故选A。
点评:解答此题需知道以下知识,增大反应物平衡向正向移动,增大生成物平衡向逆向移动

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CO(g)+H2(g);
CO(g)+H2(g); CO2(g)+H2(g)
CO2(g)+H2(g) 3C(g)。
3C(g)。 H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深 pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是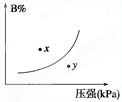
 C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是  2Z(g)△H﹤0,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图2—16所示。则下述判断正确的是( )
2Z(g)△H﹤0,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图2—16所示。则下述判断正确的是( )