题目内容
反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ②x点表示的正反应速率大于逆反应速率 ③n>p ④x点比y点时的反应速率慢 ⑤若升高温度,该反应的平衡常数增大
 pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③n>p ④x点比y点时的反应速率慢 ⑤若升高温度,该反应的平衡常数增大
| A.①②⑤ | B.只有②④ | C.只有①③ | D.①③⑤ |
B
试题分析:反应mA(s)+nB(g)
 pC(g) ΔH<0,在一定温度下,从平衡时B的体积分数(B%)与压强变化的关系可以看到:随着压强的增大,B的体积分数在增大,则n<p,该反应是放热反应,所以升高温度,平衡向逆向移动,所以平衡常数会减小。X点时B的浓度大于平衡时的浓度,说明反应正在向正向移动,所以正反应的速率大于逆反应的速率。X点的压强小于y点的压强,所以x点的反应速率速率小于y点速率。故选B。
pC(g) ΔH<0,在一定温度下,从平衡时B的体积分数(B%)与压强变化的关系可以看到:随着压强的增大,B的体积分数在增大,则n<p,该反应是放热反应,所以升高温度,平衡向逆向移动,所以平衡常数会减小。X点时B的浓度大于平衡时的浓度,说明反应正在向正向移动,所以正反应的速率大于逆反应的速率。X点的压强小于y点的压强,所以x点的反应速率速率小于y点速率。故选B。点评:.对于化学平衡的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
(2)紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平,数值大。例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
 CH3OH(g) ΔH,在不同温度下的化学平衡常数(K)如表所示。
CH3OH(g) ΔH,在不同温度下的化学平衡常数(K)如表所示。
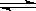 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下: 此时上述的反应中正、逆反应速率的关系式是 (填代号)。
此时上述的反应中正、逆反应速率的关系式是 (填代号)。 b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A)变为原平衡的40%,下列说法正确的是
b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A)变为原平衡的40%,下列说法正确的是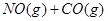

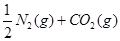
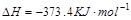

 H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2)=n(H2)=1 mol;乙:n(CO2)=1 mol, n(H2)=2mol;丙:n(CO2)=n(H2)=1mol n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是( )
H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2)=n(H2)=1 mol;乙:n(CO2)=1 mol, n(H2)=2mol;丙:n(CO2)=n(H2)=1mol n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是( ) nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )
nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )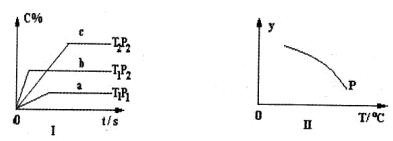
 2AB2(g) 达到平衡状态的标志是 ( )
2AB2(g) 达到平衡状态的标志是 ( )