题目内容
19.某工厂用NH3•H2O、CO2和制磷肥得到的副产品石膏(CaSO4•2H2O)制备硫酸钾晶体,其工艺流程如图: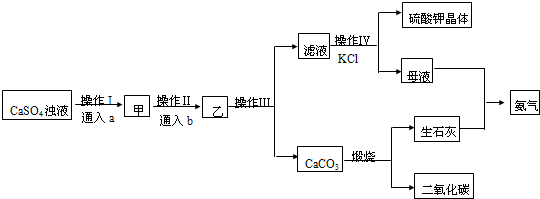
请回答下列问题:
(1)写出该流程中CaSO4浊液与a、b反应的化学方程式:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓
(2)操作I和操作Ⅱ中通入的a和b以及用量的关系分别为B(填序号)
A.足量的CO2,适量的NH3 B.足量的NH3,适量的CO2
C.适量的CO2,足量的NH3 D.少量的NH3,足量的CO2
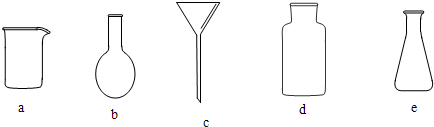
(3)实验室完成操作Ⅲ所需的仪器有铁架台、玻璃棒以及ac(填序号),其中玻璃棒的作用是引流
(4)操作Ⅳ中滤液与KCl需在浓氨水中发生反应.析出K2SO4晶体.此反应的基本类型是复分解反应.浓氨水的作用是降低硫酸钾的溶解度,利于硫酸钾的析出,反应需在密闭容器中进行的原因是浓氨水易挥发,该操作得到的母液中所含的主要阳离子的检验方法是取溶液少许,向其中加入NaOH溶液并加热,生成有刺激性气味的气体并能使湿润的红色石蕊试纸变蓝.
(5)物质的循环使用,能节约资源,上述流程中循环使用的物质是CO2、NH3(写分子式)
分析 向硫酸钙浊液中通入氨气后,溶液显示碱性,然后再通入适量CO2,反应化学反应:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓,过滤后得到硫酸氨滤液和碳酸钙沉淀,硫酸氨溶液中加入氯化钾,根据溶解度差异,可以得到溶解度较小的硫酸钾晶体和氯化铵溶液,碳酸钙高温下分解得到的氧化钙溶于水,可以得到氢氧化钙,氢氧化钙和氯化铵之间反应,得到氨气,可以循环使用.
(1)向硫酸钙浊液中通入氨气后,溶液显示碱性,然后再通入适量CO2,会发生复分解反应;
(2)CO2微溶于水,NH3易溶于水,先通入足量NH3,使溶液呈碱性,然后再通入适量CO2,可以保证二氧化碳被充分吸收;
(3)固体和溶液的分离,应为过滤,根据过滤用到的仪器来回答;
(4)根据物质的溶解度大小不同,确定析出的物质以及发生的反应类型,反应应需在密闭容器中进行,防止浓氨水的挥发,根据铵根离子具有的性质检验;
(5)流程中所投入的原料和尾气成分相同的物质可循环使用.
解答 解:向硫酸钙浊液中通入氨气后,溶液显示碱性,然后再通入适量CO2,反应化学反应:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓,过滤后得到硫酸氨滤液和碳酸钙沉淀,硫酸氨溶液中加入氯化钾,根据溶解度差异,可以得到溶解度较小的硫酸钾晶体和氯化铵溶液,碳酸钙高温下分解得到的氧化钙溶于水,可以得到氢氧化钙,氢氧化钙和氯化铵之间反应,得到氨气,可以循环使用.
(1)向硫酸钙浊液中通入氨气后,溶液显示碱性,然后再通入适量CO2,反应化学反应:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓,故答案为:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓;
(2)由于CO2微溶于水,NH3易溶于水,应先通入足量NH3,使溶液呈碱性,然后再通入适量CO2,故选B;
(3)操作III为CaCO3和溶液的分离,应为过滤,过滤时所需要的仪器有烧杯、普通漏斗以及玻璃棒,玻璃棒的作用是引流,防止液体外溅,故答案为:ac;引流;
(4)操作IV滤液硫酸铵溶液与KCl需在浓氨水中发生反应,析出K2SO4晶体,原理是物质的溶解度大小不同,物质间发生复分解,析出溶解度小的物质,浓氨水的作用是降低硫酸钾的溶解度,利于硫酸钾的析出,应需在密闭容器中进行,防止浓氨水的挥发,该操作得到的母液中所含的主要阳离子是铵根离子,检验方法是取溶液少许,向其中加入NaOH溶液并加热,生成有刺激性气味的气体并能使湿润的红色石蕊试纸变蓝,
故答案为:复分解反应;降低硫酸钾的溶解度,利于硫酸钾的析出;浓氨水易挥发;取溶液少许,向其中加入NaOH溶液并加热,生成有刺激性气味的气体并能使湿润的红色石蕊试纸变蓝;
(5)a为NH3,b为CO2,所投入的原料和尾气成分相同,则CO2、NH3可循环使用故答案为:CO2、NH3,故答案为:CO2、NH3.
点评 本题考查制备实验方案的设计,题目难度中等,注意学习中要善于积累基本化学实验操作知识,把握实验原理是解答该题的关键.

 名校课堂系列答案
名校课堂系列答案| A. | 生成CO2的物质的量为2 mol | B. | 生成CO2的体积为4.48L | ||
| C. | 生成O2的体积为4.48L | D. | 生成CO2的分子数为1.204×1023个 |
| A. | 该温度下KOH的溶解度为$\frac{2a}{1-2a%}$g | |
| B. | 原溶液的质量为3mg | |
| C. | 可以求算原溶液的物质的量浓度 | |
| D. | 保持温度不变,向原溶液中加入2a g KOH可达饱和 |
(1)碱性:Sr(OH)2< Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是同一主族元素,原子最外层电子数相同.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3.
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
②Ⅱ中,能与盐酸反应溶解的物质有SrCO3、BaCO3、FeO、Fe2O3、Al2O3.
③Ⅳ的目的是将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全.
④下列关于该工艺流程的说法正确的是ac.
a.该工艺产生的废液含较多的NH4+、Na+、Cl-、SO42-
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率.
| A. | 1 mol 过氧化钠中阴离子所带的负电荷数为NA | |
| B. | mg${\;}_{Z}^{A}$Xn-中所含电子总数为(Z+n)m$\frac{N_A}{A}$ | |
| C. | 100mL 0.1mol•L-1的稀醋酸中含有H+个数为0.01NA | |
| D. | 11.2L CO2所含的原子个数为1.5NA |
| A. | 该反应中氨气是还原剂 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 该反应HCl是氧化产物 | D. | 生成1molN2有6mol电子转移 |