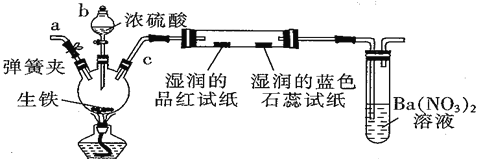
题目内容
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A. K2和K1的单位均为mol·L-1
B. K2>K1
C. c2(CO)=c2(H2O)
D. c1(CO)>c2(CO)
【答案】C
【解析】
A、由化学平衡CO(g)+H2O(g)CO2(g)+H2(g)△H<0,则平衡常数表达式K=![]() ,所以K的单位为1,不是mol/L,故A错误;B、升高反应体系的温度至t2时,正向反应是放热反应。所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行,K2<K1,故B正确;C、t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,浓度之比等于化学计量数之比1:1,二者转化率相等,故新平衡状态下,c2(CO)和c2(H2O)仍相同,故C错误;D、升高反应体系的温度至t2时,平衡逆向进行,所以c2(CO)>c1(CO),故D错误;故选B。
,所以K的单位为1,不是mol/L,故A错误;B、升高反应体系的温度至t2时,正向反应是放热反应。所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行,K2<K1,故B正确;C、t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,浓度之比等于化学计量数之比1:1,二者转化率相等,故新平衡状态下,c2(CO)和c2(H2O)仍相同,故C错误;D、升高反应体系的温度至t2时,平衡逆向进行,所以c2(CO)>c1(CO),故D错误;故选B。

练习册系列答案
相关题目