题目内容
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(相对分子质量为376)是一种氧气吸收剂,为红棕色晶体,潮湿时易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
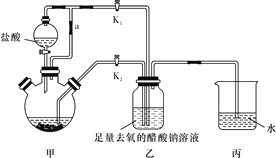
①待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
②将装置乙中混合物快速过滤、洗涤和干燥,称量得到 [Cr(CH3COO)2]2·2H2O。
③检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
④关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
(1)正确的实验步骤为:_________________。
(2)装置甲中连通管a的作用是_______________________________________。
(3)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为_______________________________________________。
(4)实现步骤①中溶液自动转移至装置乙中的实验操作为_______________________。
(5)步骤④目的是___________________________________________。
(6)洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是_________________。
(7)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.48g,则该实验所得产品的产率为____(不考虑溶解的醋酸亚铬水合物)(用百分数表示,保留3位有效数字)。
【答案】③④①② 平衡气压,使分液漏斗中的盐酸顺利流下 2Cr3++Zn===2Cr2++Zn2+ 关闭K1,打开K2 让Zn与盐酸反应生成的H2排尽装置内的空气,防止产品被氧化 为了去除可溶性杂质和水分 84.0%
【解析】
(1) 装置甲:分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,生成氢气,用来增大压强把生成的CrCl2溶液压入装置乙中;装置乙:2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O↓,装置丙是保持装置压强平衡,同时避免空气进入,故正确的实验步骤为:③④①②;
(2)装置甲中连通管a的作用是平衡气压,使分液漏斗中的盐酸顺利流下;
(3)装置甲:分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,,该反应的离子反应为:2Cr3++Zn===2Cr2++Zn2+;
(4)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置乙中反应,故答案为:关闭k1,打开k2;
(5)步骤④目的是让Zn与盐酸反应生成的H2排尽装置内的空气,防止产品被氧化;
(6)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,所以可以选用冷水、无水乙醇和乙醚洗涤[Cr(CH3COO)2]2·2H2O产品,洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是为了去除可溶性杂质和水分;
(7)CrCl3为![]() =0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则理论上可以得到[Cr(CH3COO)2]22H2O的质量为0.06mol×
=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则理论上可以得到[Cr(CH3COO)2]22H2O的质量为0.06mol×![]() ×376g/mol=11.28g,所得产品的产率为
×376g/mol=11.28g,所得产品的产率为 ![]() ×100%=84.0%。
×100%=84.0%。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。