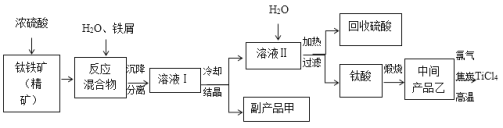
题目内容
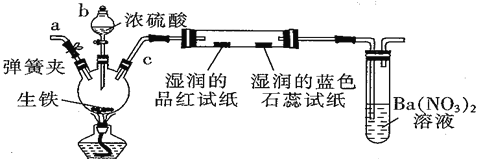
【题目】某化学兴趣小组为研究生铁(含少量碳)与浓硫酸的反应情况及产物性质,设计如下实验装置(夹持装置及尾气处理装置未画出)。请回答下列问题:
A B C
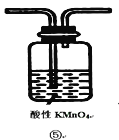
(1)仪器b 的名称为____________,按照上图装置进行实验,实验过程中,装置B中的现象是湿润的品红试纸__________________,湿润的蓝色石蕊试纸____________ 。若观察到装置C中会出现白色沉淀,原因是_____________________________。
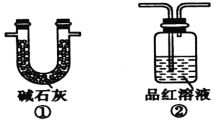

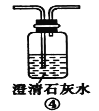
(2)装置A中还会产生能够使得澄清石灰水变浑浊的另一种气体,请写出产生该气体的化学方程式____________________________为了验证该气体,应从下列①~⑤中选出必要的装置连接装置A中出口C处,从左到右的顺序是_____________(填序号),连接好装置,然后打开弹簧夹a,多次鼓入N2,其目的是________________________________。
【答案】分液漏斗 褪色 变红 SO2水溶液呈酸性,NO3-在酸性条件下使之氧化为SO42-,结合Ba2+生成BaSO4. C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑ ⑤②④或⑤④ 赶尽装置中的空气,防止空气中的CO2干扰实验
2H2O+CO2↑+2SO2↑ ⑤②④或⑤④ 赶尽装置中的空气,防止空气中的CO2干扰实验
【解析】
(1)由装置图可知,生铁中的铁和碳在装置A中与浓硫酸共热反应,生成硫酸铁、二氧化硫、二氧化碳和水,反应生成的二氧化硫具有漂白性,能使装置B中湿润的品红试纸漂白褪色,二氧化硫和二氧化碳是酸性氧化物,与水反应生成酸,能使装置B中湿润的蓝色石蕊试纸变红色,NO3-在酸性条件下将二氧化硫氧化生成硫酸,硫酸与硝酸钡反应生成硫酸钡沉淀;
(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳;由于装置有空气,空气中含有二氧化碳,开始鼓入氮气,排尽装置中的空气。
(1)由装置图可知,仪器b为分液漏斗,生铁(含碳)与浓硫酸共热反应生成硫酸铁、二氧化硫、二氧化碳和水,反应生成的二氧化硫具有漂白性,可使湿润的品红试纸褪色,二氧化硫和二氧化碳是酸性氧化物,与水反应生成酸,湿润的石蕊试纸变红;NO3-在酸性条件下将二氧化硫氧化生成硫酸,硫酸与硝酸钡反应生成硫酸钡沉淀,故答案为:分液漏斗;品红试纸褪色,石蕊试纸变红;SO2水溶液呈酸性,NO3-在酸性条件下使之氧化为SO42-,结合Ba2+生成BaSO4;
(2)装置A中碳也与浓硫酸反应生成二氧化碳、二氧化硫与水,反应方程式为C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑;二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,则从左到右的顺序为⑤②④;空气中二氧化碳会干扰反应生成二氧化碳的检验,加热前打开弹簧夹a,目的是赶尽装置中的空气,防止空气中的CO2干扰实验,故答案为:C+2H2SO4(浓)
2H2O+CO2↑+2SO2↑;二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,则从左到右的顺序为⑤②④;空气中二氧化碳会干扰反应生成二氧化碳的检验,加热前打开弹簧夹a,目的是赶尽装置中的空气,防止空气中的CO2干扰实验,故答案为:C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑;⑤②④;赶尽装置中的空气,防止空气中的CO2干扰实验。
2H2O+CO2↑+2SO2↑;⑤②④;赶尽装置中的空气,防止空气中的CO2干扰实验。

【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
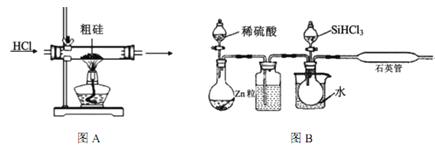
【题目】半导体工业需要高纯硅,粗硅中含有SiO2、Fe2O3、CuO、C等杂质,提纯硅的方法比较多,其中三氯氢硅(有一定毒性)氢还原法和四氯化硅氢还原法应用较为广泛,下面是实验室模拟工业上三氯氢硅氢还原法的基本原理:
已知:①Si+3HCl ![]() SiHCl3+H2(主要反应)
SiHCl3+H2(主要反应)
Si+4HCl![]() SiCl4+2H2(次要反应)
SiCl4+2H2(次要反应)
2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②典型硅的重要化合物的部分性质如下表:
熔点(℃) | 沸点(℃) | 溶解性 | |
SiHCl3 | -127 | 33 | 易溶于多数有机溶剂 |
SiCl4 | -23 | 77 | 易溶于多数有机溶剂 |
(1)粗硅在提纯前,需要进行酸、碱预处理,其目的是___________________________________。
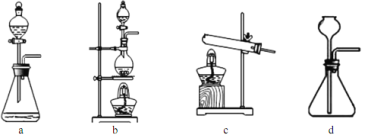
(2)下列装置在实验室可用于制备HCl气体的是_____(填字母代号)。
(3)在1100~1200℃条件下,利用图B在石英管中可以获得硅,写出该反应的方程式_______;其烧杯中水的作用是__________________________;该装置使用石英管而不是普通玻璃管的原因是_________。
(4)三氯氢硅氢还原法用 SiHCl3在图B中制硅,不足之处有_______________(任意回答一点即可)。
(5)SiCl4与氢气反应也能得到硅,但反应所需温度不同,在工业上往往将三氯氢硅中混入的SiCl4分离后再与氢气反应,你认为最好的分离方法是______________。
(6)工业上如果用四氯化硅氢还原法制硅,其原理如下:![]() 该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。