题目内容
8.以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下: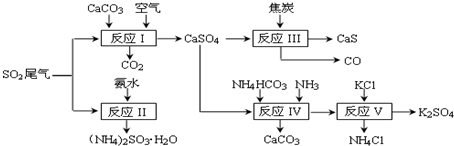
(1)写出反应Ⅰ的化学方程式2CaCO3+2SO2+O2═2CaSO4+2CO2.
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是防止亚硫酸铵被氧化.
(3)下列有关说法正确的是acd.
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4:1
c.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出.
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式4(NH4)2SO3+2NO2=4(NH4)2SO4+N2.
分析 (1)根据反应物和生成物写出反应的化学方程式;
(2)亚硫酸氨中的硫为+4价,易被空气中的氧气氧化;
(3)a.依据流程图结合反应生成物分析,过量的空气把亚硫酸钙氧化为硫酸钙;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C;
c.防止碳酸氢铵在温度过高时分解;
d.氯化铵是一种氮肥;
(4)利用硫酸钾在不同溶剂中溶解度的不同,达到析出晶体的目的;
(5)二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,结合原子守恒配平写出.
解答 解:(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,反应的方程式为:2CaCO3+2SO2+O2═2CaSO4+2CO2,
故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
(2)对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,
故答案为:防止亚硫酸铵被氧化;
(3)a.过量的空气把亚硫酸钙氧化为硫酸钙,故a正确;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故b错误;
c.防止碳酸氢铵在温度过高时分解得不到需要的目标产物,故c正确;
D、氯化铵含N元素,是一种氮肥,故d正确;
故答案为:acd;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
(5)④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2,
故答案为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2.
点评 本题考查二氧化硫的性质及物质的制备,为高频考点,题目难度中等,把握习题中的信息及发生的反应为解答的关键,侧重二氧化硫的还原性及学生分析能力的考查.

INDICALM消化药片每片含250mg碳酸钙
Stomachease减缓胃痛每片含250mg氢氧化镁
Fast digestion帮助消化每片含250mg氧化镁
药品中所含的物质均能与胃里过量的盐酸反应,则相同粒数的三种药片消耗HCl的物质的量比较,正确的是( )
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
| A. | 所有主族元素原子的最外层电子数都等于元素的最高正化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 第IA族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
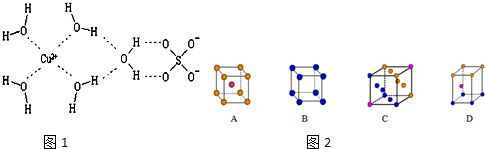
| A. | 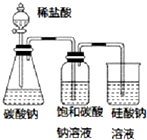 图中的实验现象能证明非金属性:Cl>C>Si | |
| B. | 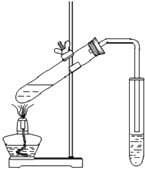 图可用于实验室制备并收集乙酸乙酯 | |
| C. |  图中,气体从a口进入时,可用于收集H2、CH4、NH3等气体 | |
| D. | 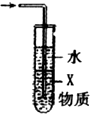 图中X若为CCl4,可用于吸收NH3或HCl |
| A. | Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA | |
| B. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA | |
| D. | 1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: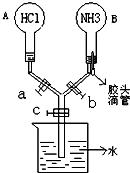 如图所示的装置,实验前a、b、c活塞均关闭.
如图所示的装置,实验前a、b、c活塞均关闭.