题目内容
6.在常温下,某兴趣小组模拟“侯氏制碱法”制取碳酸钠,流程如图1: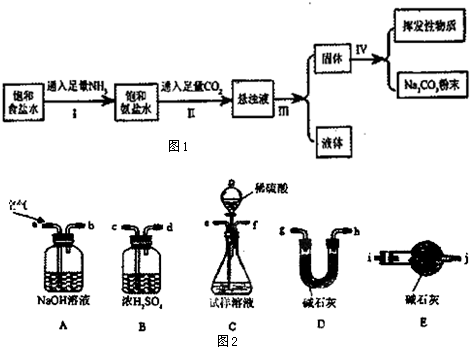
在常温下,有关物质的溶解度为:
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
(2)操作I、II总反应的离子方程式为Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(3)操作I和II不能颠倒的原因由于NH3在饱和NaCl溶液中溶解量比CO2大,先通NH3,溶液呈碱性,更易吸收CO2,有利NaHCO3的生成,所以应先通入NH3;
(4)检验所得的碳酸钠粉末是否含有NaHCO3,的实验方案是(写出操作步骤、现象、结论):取少量产物于试管,加热,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3;
(5)为了测定所制取产物的纯度(假设杂质只有碳酸氢钠).该小组的实验步骤为:
i.使用下列装置组装实验装置,并检查气密性
ii.称取Wg产品放入C装置的锥形瓶中,加适量蒸馏水溶解
iii.称量D装置的质量为W1 g
iv.从分液漏斗滴入稀硫酸,直到不再产生气体为止
v.从a处缓缓鼓入一定量的空气,再次称量D装置质量为W2 g
vi.重复步骤v的操作,直到D装置的质量不再改变,称得D装置的质量为W3 g
根据上述实验回答如下问题:
①第i步,使用上述装置连接的接口顺序为:(b)→(e)(f)→(c)(d)→(g)(h)[或(h)(g)]→(i).
②第二个盛碱石灰装置的作用是防止空气进入D中碱石灰干扰实验.
③产物中碳酸钠和碳酸氢钠的物质的量之和为$\frac{{w}_{3}-{w}_{1}}{44}$mol.
分析 (1)把固体与液体所形成混合物中固体分离出来的方法为过滤,据此分析解答;
(2)根据溶解度表可知,碳酸氢钠的溶解度比碳酸钠小,经过操作I和操作II,溶液中离子反应的本质为二氧化碳和水结合生成碳酸,氨气和水结合生成一水合氨,碳酸和一水合氨反应,钠离子和碳酸氢根离子结合生成碳酸氢钠沉淀;
(3)二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,所以操作I和II不能颠倒;
(4)根据碳酸钠和碳酸氢钠的性质差异进行解答,碳酸氢钠受热易分解;
(5)①测定所制取产物的纯度(假设杂质只有碳酸氢钠),需将碳酸钠和碳酸氢钠变为二氧化碳,通过碱石灰吸收来测量,因空气中有二氧化碳,所以需先除掉空气中的二氧化碳,将装置中的产生二氧化碳排净,据此分析连接装置;
②防止空气进入前一个碱石灰中干扰实验;
③利用碳原子守恒计算.
解答 解:(1)二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,操作Ⅲ中的实验操作目的是将沉淀和溶液分开,所以通过过滤,可把混在溶液中的碳酸氢钠晶体分离出来,
故答案为:过滤;
(2)因为氨气的溶解度比二氧化碳大得多,且溶液呈碱性,有利于二氧化碳的吸收;所以操作I先通入足量的氨气,操作II将二氧化碳通入氨化的饱和氯化钠溶液中,根据溶解度表可知,碳酸氢钠的溶解度比碳酸钠小,所以发生NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,本质为Na++NH3+CO2+H2O═NaHCO3↓+NH4+,
故答案为:Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(3)二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵,
故答案为:由于NH3在饱和NaCl溶液中溶解量比CO2大,先通NH3,溶液呈碱性,更易吸收CO2,有利NaHCO3的生成;所以应先通入NH3;
(4)碳酸氢钠受热易分解,如果碳酸钠中含有碳酸氢钠,取少量产物于试管,加热发生2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2↑,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3,
故答案为:取少量产物于试管,加热,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3;
(5)①空气经过氢氧化钠的洗气瓶可将空气中的二氧化碳吸收,连接试样溶液可将装置中的产生的二氧化碳排出,所以(b)→(e)(f),从试样溶液中产生的二氧化碳混有水蒸气,所以需通过浓硫酸干燥二氧化碳,所以连接→(c)(d),最后通过碱石灰吸收产生的二氧化碳,所以连接→(g)(h)[或(h)(g)]→(i),
故答案为:(c)(d);(g)(h)[或(h)(g)]→(i);
②空气中的二氧化碳和水蒸气进入前面的碱石灰,会使碱石灰的质量偏大,产生误差,所以后面要加一个盛有碱石灰的装置,防止空气进入前一个碱石灰中干扰实验;
故答案为:防止空气进入D中碱石灰干扰实验;
③碳酸钠和碳酸氢钠与稀硫酸反应生成二氧化碳,二氧化碳被D装置吸收,则D的质量变化值即是二氧化碳的质量,则二氧化碳的质量为(W3-W1)g,则二氧化碳的物质的量为$\frac{{w}_{3}-{w}_{1}}{44}$mol,由碳原子守恒可知碳酸钠和碳酸氢钠的物质的量之和为$\frac{{w}_{3}-{w}_{1}}{44}$mol;
故答案为:$\frac{{w}_{3}-{w}_{1}}{44}$.
点评 本题以工业生产纯碱的工艺流程为背景,考查了物质的提纯、化学实验基本操作、实验结果的处理等知识,把握纯碱的制备原理以及物质的性质是解答本题的关键,题目难度中等.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 | |
| C. | 摩尔是表示物质的粒子个数的单位,简称摩,符号为mol | |
| D. | 1mol氧含6.02×1023个O2 |
| A. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 少量SO2通入NaOH溶液:SO2+OH-═HSO3- | |
| C. | FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所做的电极(正极或负极)不同(填“相同”或“不同”).
(2)实验3中,铝为负极,电极反应式:2Al-6e-═2Al3+.
(3)实验4中,铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| A. | 将(CH3)3CCH2Cl与氢氧化钾的乙醇溶液加热一段时间后冷却,再滴加硝酸酸化的硝酸银溶液,可观察到有白色沉淀产生 | |
| B. | 新制氢氧化铜悬浊液可检验失去标签的乙醛、乙酸、乙酸乙酯、葡萄糖溶液(必要时可加热) | |
| C. | 制备乙酸乙酯时加入试剂的顺序是,在一支试管中加入3mL浓硫酸,然后慢慢加入2mL无水乙醇和2mL无水乙酸 | |
| D. | 向淀粉溶液中加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,若加热后未见砖红色沉淀生成 说明淀粉未开始水解 |
 CH3COO-+H+.
CH3COO-+H+.

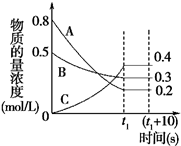 如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题: