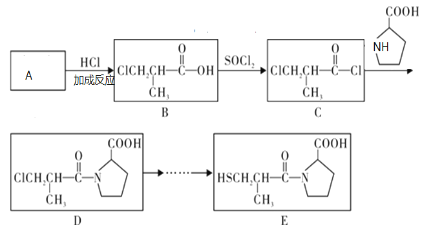
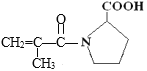
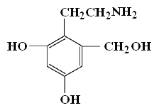
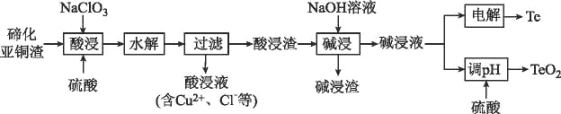
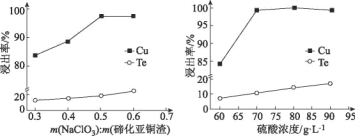
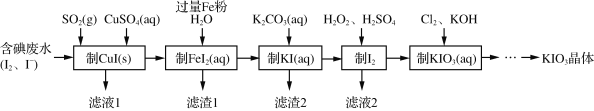
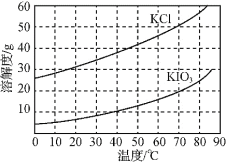
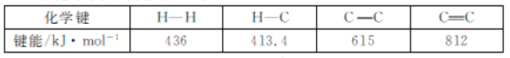
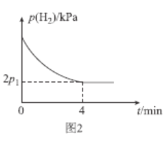
题目内容
【题目】常温下,向20 mL 0.1 molL-1的MOH溶液中逐滴加入0.1 molL-1 HCl溶液,滴定曲线如图所示。请回答下列问题:
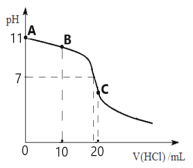
(1)请写出MOH的电离方程式__________________________,常温下,该碱的电离平衡常数Kb=_________。
(2)滴定到B点时,溶液中各离子浓度由大到小的顺序是_________________________。
(3)C点所对应的溶液呈_____性,用离子方程式表示其原因______________________。
(4)图中A、B、C三点溶液中水的电离程度由大到小的顺序是_______________________。
【答案】MOH![]() M++OH- 10-5 c(M+)>c(Cl-)>c(OH-)>c(H+) 酸 M++H2O
M++OH- 10-5 c(M+)>c(Cl-)>c(OH-)>c(H+) 酸 M++H2O![]() MOH+H+ C>B>A
MOH+H+ C>B>A
【解析】
(1)根据图像可知,溶液的pH=11,c(OH-)=10-3mol/L,MOH溶液的浓度为0.1 molL-1,MOH为弱碱;
(2)滴定到B点时,溶质为MOH、MCl,且物质的量相等,此溶液显碱性,即MOH的电离程度大于MCl的水解程度;
(3)根据图像可知,C点溶液为MCl溶液,其溶质为强酸弱碱盐,溶液显酸性;M离子水解生成MOH和氢离子;
(4)A点为MOH溶液,抑制水的电离;B点为MOH、MCl混合溶液,MOH抑制水的电离,MCl促进水的电离;C点为MCl,为盐溶液,促进水的电离。
(1)根据图像可知,溶液的pH=11,c(OH-)=10-3mol/L,MOH溶液的浓度为0.1 molL-1,MOH为弱碱,电离方程式为MOH![]() M++OH-;
M++OH-;
(2)滴定到B点时,溶质为MOH、MCl,且物质的量相等,此溶液显碱性,即MOH的电离程度大于MCl的水解程度,则c(M+)>c(Cl-)>c(OH-)>c(H+);
(3)根据图像可知,C点溶液为MCl溶液,其溶质为强酸弱碱盐,溶液显酸性;M离子水解生成MOH和氢离子,离子方程式为M++H2O![]() MOH+H+;
MOH+H+;
(4)A点为MOH溶液,抑制水的电离;B点为MOH、MCl混合溶液,MOH抑制水的电离,MCl促进水的电离;C点为MCl,为盐溶液,促进水的电离,则水的电离程度由大到小的顺序为C>B>A。