题目内容
【题目】一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
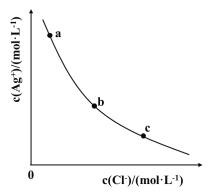
A.a、b、c三点对应的Ksp 不相等
B.AgCl在c点的溶解度比b点的大
C.AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-)
D.b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化
【答案】C
【解析】
由图象可以看出,随着![]() 浓度的增大,
浓度的增大,![]() 浓度逐渐减小,在曲线上的点为溶解平衡状态,当
浓度逐渐减小,在曲线上的点为溶解平衡状态,当![]() 时,可产生沉淀,
时,可产生沉淀,![]() 或
或![]() 增大会抑制
增大会抑制![]() 的溶解,使其溶解度降低,但温度不变,则Ksp不变,因为Ksp只与温度有关,据此分析解答。
的溶解,使其溶解度降低,但温度不变,则Ksp不变,因为Ksp只与温度有关,据此分析解答。
A. 温度不变,则Ksp不变,所以a、b、c三点对应的Ksp相等,A错误;
B. ![]() 或
或![]() 越大抑制
越大抑制![]() 的溶解程度越大,使其溶解度降低越大,c点时
的溶解程度越大,使其溶解度降低越大,c点时![]() 大,所以c点抑制
大,所以c点抑制![]() 的溶解程度大,即
的溶解程度大,即![]() 在c点的溶解度比b点的小,B错误;
在c点的溶解度比b点的小,B错误;
C. ![]() 溶于水形成的饱和溶液中有
溶于水形成的饱和溶液中有![]() ,所以
,所以![]() ,C正确;
,C正确;
D. 饱和溶液中加入![]() 固体,则
固体,则![]() 增大,由于
增大,由于![]() ,所以溶液中
,所以溶液中![]() 减小,即
减小,即![]() 沿曲线向a点方向变化,D错误;
沿曲线向a点方向变化,D错误;
故答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
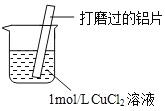
【题目】探究Al与CuCl2溶液反应,实验如下:下列说法不正确的是( )
实验 | 现象 |
| a.Al片表面附着蓬松的红色固体 b.产生无色气体,起始速率较慢,之后加快 c.反应放热 d.烧杯底部产生少量不溶于稀盐酸的白色沉淀 e.溶液pH降低 |
A.无色气体是H2
B.实验中影响化学反应速率的因素只有两个,分别是浓度和温度
C.白色沉淀的出现与氧化还原反应有关
D.将铝片改为铝粉会加快化学反应速率