题目内容
【题目】下列化学方程式书写不正确的是
A.苯与浓硝酸反应:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
B.苯酚钠溶液与二氧化碳反应:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
C.溴乙烷消去反应:CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr +H2O
CH2=CH2↑+NaBr +H2O
D.乙醛与银氨溶液反应:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+ 2Ag↓+ 3NH3 +H2O
CH3COONH4+ 2Ag↓+ 3NH3 +H2O
【答案】B
【解析】
A. 苯与浓硝酸反应生成硝基苯和水,反应的化学方程式为:![]() +HNO3
+HNO3![]()
![]() +H2O,选项A正确;
+H2O,选项A正确;
B. 苯酚钠溶液与二氧化碳反应生成苯酚和碳酸氢钠,反应的化学方程式为:![]() +CO2+H2O→
+CO2+H2O→![]() +NaHCO3,选项B不正确;
+NaHCO3,选项B不正确;
C. 溴乙烷在氢氧化钠的乙醇溶液中加热发生消去反应生成乙烯、溴化钠和水,反应的化学方程式为:CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr +H2O,选项C正确;
CH2=CH2↑+NaBr +H2O,选项C正确;
D. 乙醛与银氨溶液反应生成乙酸铵、银、氨气和水,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+ 2Ag↓+ 3NH3 +H2O,选项D正确;
CH3COONH4+ 2Ag↓+ 3NH3 +H2O,选项D正确;
答案选B。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.1 mol·L-1KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
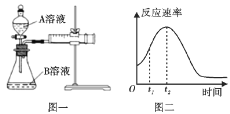
(1)该实验探究的是___因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)__mol·L-1(假设混合液体积为50mL)。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变