题目内容
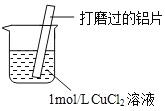
【题目】探究Al与CuCl2溶液反应,实验如下:下列说法不正确的是( )
实验 | 现象 |
| a.Al片表面附着蓬松的红色固体 b.产生无色气体,起始速率较慢,之后加快 c.反应放热 d.烧杯底部产生少量不溶于稀盐酸的白色沉淀 e.溶液pH降低 |
A.无色气体是H2
B.实验中影响化学反应速率的因素只有两个,分别是浓度和温度
C.白色沉淀的出现与氧化还原反应有关
D.将铝片改为铝粉会加快化学反应速率
【答案】B
【解析】
在CuCl2溶液中,存在Cu2++2H2O![]() Cu(OH)2+2H+,Al与H+反应产生H2;Al与Cu2+还能发生置换反应,生成Al3+和Cu;反应放热,速率加快;Al可能会将CuCl2还原为CuCl白色沉淀;另外,温度升高,Cu2+水解程度增大,c(H+)增大,pH减小。
Cu(OH)2+2H+,Al与H+反应产生H2;Al与Cu2+还能发生置换反应,生成Al3+和Cu;反应放热,速率加快;Al可能会将CuCl2还原为CuCl白色沉淀;另外,温度升高,Cu2+水解程度增大,c(H+)增大,pH减小。
A.由以上分析可知,无色气体是H2,A正确;
B.实验中影响化学反应速率的因素除去反应物本身的性质,还有浓度、温度、接触面积等,B不正确;
C.由以上分析可知,白色沉淀是Al将CuCl2还原而得,C正确;
D.将铝片改为铝粉,增大了固体与溶液的接触面积,加快了反应速率,D正确;
故选B。

【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
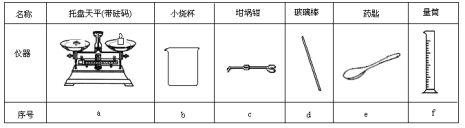
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
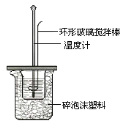
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
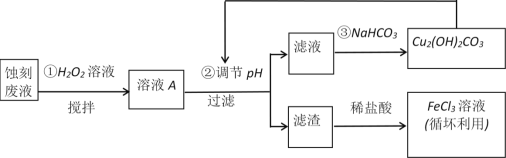
请回答:
(1)把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________。
(2)FeCl3蚀刻液中加入盐酸的目的是______________________________。
(3)步骤①中加入H2O2溶液的目的是(用离子方程式表示)_____________________。
(4)已知:生成氢氧化物沉淀的pH如下表
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是________________。
(5)上述流程路线中,除FeCl3溶液外,还可用于循坏利用的物质是__________________。
【题目】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.1 mol·L-1KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
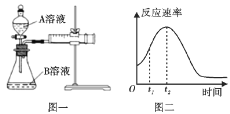
(1)该实验探究的是___因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)__mol·L-1(假设混合液体积为50mL)。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变