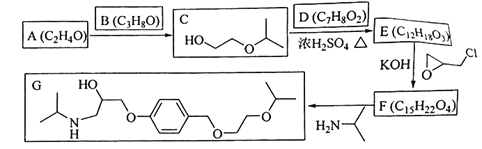
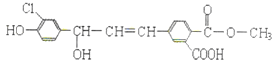题目内容
【题目】X溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种成几种,取该溶液进行实验,实验内容和相关数据
中的一种成几种,取该溶液进行实验,实验内容和相关数据![]() 气体体积在标准状况下测定
气体体积在标准状况下测定![]() 如下:
如下:
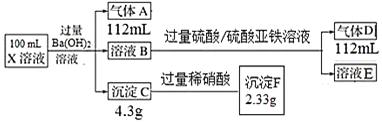
![]() 溶液中一定不存在的离子是______。
溶液中一定不存在的离子是______。
![]() 已知气体D为NO,加入过量
已知气体D为NO,加入过量![]() 和
和![]() 溶液时,发生反应的离子方程式为______。
溶液时,发生反应的离子方程式为______。
![]() 溶液中
溶液中![]() ______
______![]() ,
,![]() ______
______![]() 。
。
【答案】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
![]()
![]()
![]()
【解析】
![]() 在沉淀C中加入过量硝酸,得到
在沉淀C中加入过量硝酸,得到![]() 沉淀F,所以
沉淀F,所以![]() 沉淀质量为
沉淀质量为![]() ,即溶液中含有
,即溶液中含有![]() ,由于
,由于![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 与
与![]() 不共存,则溶液中一定不含有
不共存,则溶液中一定不含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,
,
故答案为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;
;
![]() 在溶液B中加入硫酸、硫酸亚铁溶液生成气体D,即A为NO,则溶液中含有
在溶液B中加入硫酸、硫酸亚铁溶液生成气体D,即A为NO,则溶液中含有![]() ,硝酸有强氧化性、能氧化
,硝酸有强氧化性、能氧化![]() 离子生成
离子生成![]() 和NO气体,所以反应的离子方程式为
和NO气体,所以反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
![]() 沉淀C中加入过量硝酸,得到
沉淀C中加入过量硝酸,得到![]() 沉淀F,所以
沉淀F,所以![]() 沉淀质量为
沉淀质量为![]() ,即
,即![]() ,所以
,所以![]() ,
,
溶液中![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,电荷关系为
,电荷关系为![]() ,即
,即![]() ,
,![]() ,所以
,所以![]() ,
,
故答案为:![]() ,
,![]() ;
;

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。

Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL苯和少量铁屑。在b中小心加入4.0 mL 液溴。再将b中液溴慢慢加入到a中,充分反应。装置a中发生的主要反应是___;装置d的作用是___。
(2)反应过程中,a外壁温度升高,为提高原料利用率,采取以下措施:
①采用装置c的目的是___。
②利用温度计控制温度,适宜的温度范围为(填序号)___。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。操作②所需要的玻璃仪器除烧杯外,还需___,滤液用NaOH溶液洗涤的作用是___。
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经过上述分离操作后,粗溴苯中溶解的主要杂质为苯,要进一步提纯,下列操作中必须的是___(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
【题目】电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
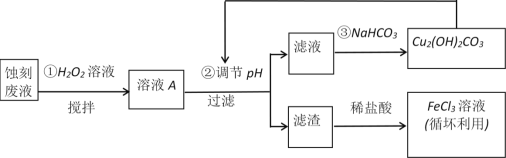
请回答:
(1)把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________。
(2)FeCl3蚀刻液中加入盐酸的目的是______________________________。
(3)步骤①中加入H2O2溶液的目的是(用离子方程式表示)_____________________。
(4)已知:生成氢氧化物沉淀的pH如下表
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是________________。
(5)上述流程路线中,除FeCl3溶液外,还可用于循坏利用的物质是__________________。