题目内容
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式是(未
配平):MnO4-+NO2-+ → Mn2++NO3-+H2O。下列叙述中正确的是( )
→ Mn2++NO3-+H2O。下列叙述中正确的是( )
| A.该反应中NO2-是还原剂 |
| B.反应过程中溶液的pH 减小 |
| C.生成1 mol NaNO3时消耗2.5 mol KMnO4 |
D. 中的粒子是OH- 中的粒子是OH- |
A
解析试题分析:A、该反应中N元素化合价由+3价变为+5价,所以亚硝酸根离子失电子被氧化是还原剂,故A正确;B、根据元素守恒、电荷守恒知,K是H+,氢离子参加反应导致溶液中氢离子浓度降低,则溶液的pH增大,故B错误;C、根据转移电子守恒得,生成1molNaNO3需消耗KMnO4的物质的量=1mol×(5?3)/(7?2)=0.4mol,故C错误;D、根据元素守恒、电荷守恒知,K是H+,故D错误;
考点:氧化还原反应

 名校课堂系列答案
名校课堂系列答案单质钛(Ti)的机械强度高,抗腐蚀能力强,有“未来金属”之称。以TiO2制金属钛,主要反应有:①TiO2+2C+2Cl2 TiCl4+2CO;②TiCl4+2Mg
TiCl4+2CO;②TiCl4+2Mg 2MgCl2+Ti下列叙述不正确的是( )
2MgCl2+Ti下列叙述不正确的是( )
| A.反应①中碳是还原剂 |
| B.反应①中TiO2是氧化剂 |
| C.反应②表现了金属镁还原性比金属钛强 |
| D.反应①中氧化剂与还原剂物质的量之比为1∶1 |
下列变化需要加入适当的氧化剂才能实现的是
A.CuO Cu Cu | B.Fe2+ Fe Fe | C.H2SO4 SO2 SO2 | D.HCl Cl2 Cl2 |
吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是
| A.作还原剂 | B.作氧化剂 |
| C.既作氧化剂又作还原剂 | D.既不作氧化剂又不作还原剂 |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2:2NaClO3+Na2SO3+H2SO4= 2ClO2↑+2Na2SO4 + H2O。下列说法正确的是
| A.氯元素的化合价升高 | B.Na2SO3是还原剂 |
| C.NaClO3发生氧化反应 | D.H2SO4被还原 |
下列变化需要加入还原剂才能实现的
A.MnO4-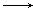 Mn2+ Mn2+ | B.HCl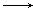 Cl2 Cl2 | C.Fe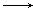 Fe3+ Fe3+ | D.KClO3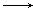 O2 O2 |
下列过程中不涉及氧化还原反应的是( )
| A.由植物油制备人造黄油 |
| B.用氯化铁溶液腐蚀印刷线路板 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体 |
已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为( )
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+4OH-=Y+S4O62-+2H2O,下列有关说法正确的是
| A.Y的化学式为Fe2O3 |
| B.S4O62- 是还原产物 |
| C.被1mol O2氧化的Fe2+物质的量为1 mol |
| D.每 32 gO2参加反应,转移电子的物质的量为4 mol |