题目内容
单质钛(Ti)的机械强度高,抗腐蚀能力强,有“未来金属”之称。以TiO2制金属钛,主要反应有:①TiO2+2C+2Cl2 TiCl4+2CO;②TiCl4+2Mg
TiCl4+2CO;②TiCl4+2Mg 2MgCl2+Ti下列叙述不正确的是( )
2MgCl2+Ti下列叙述不正确的是( )
| A.反应①中碳是还原剂 |
| B.反应①中TiO2是氧化剂 |
| C.反应②表现了金属镁还原性比金属钛强 |
| D.反应①中氧化剂与还原剂物质的量之比为1∶1 |
B
解析试题分析:A、反应①中碳化合价升高,是还原剂;B、反应①中TiO2中无化合价的变化;C、反应②中镁将钛置换出来,故表现了金属镁还原性比金属钛强;D、反应①中氧化剂与还原剂物质的量之比为1∶1。
考点:氧化还原反应

 通城学典默写能手系列答案
通城学典默写能手系列答案新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中氧化产物与还原产物物质的量之比为2:9 |
| C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物的质量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质量为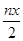 mol mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P =3P2O5+5KC1。下列有关该反应的叙述中,正确的是
| A.氯酸钾是还原剂 |
| B.反应中消耗3molP时,转移电子的物质的量为15mol |
| C.KCl既是氧化产物,又是还原产物 |
| D.发令时产生的白烟只是KC1固体颗粒 |
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下: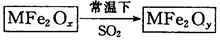
则下列判断正确的是
| A.MFe2Ox是还原剂 | B.SO2是该反应的催化剂 |
| C.x>y | D.SO2发生了置换反应 |
两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=" NO" +SO3,在体积为V L的密闭容器中通入3molNO2和5molSO2, 反应后容器内氮原子和氧原子个数比为( )
| A.3/10 | B.16/3 | C.3/16 | D.5/16 |
下列变化不属于氧化还原反应的是
| A.加热氢氧化铁固体 | B.金属钠露置于空气中 |
| C.铜丝放入浓硫酸中并加热 | D.将氯气通入冷的消石灰浊液中 |
已知:2BrO3- +Cl2=Br2 +2ClO3-;5Cl2 +I2 +6H2O=2HIO3 +10HCl;ClO3-+5Cl-+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序为
| A.BrO3->ClO3->IO3->Cl2 | B.BrO3->Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->ClO3->IO3- |
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式是(未
配平):MnO4-+NO2-+ → Mn2++NO3-+H2O。下列叙述中正确的是( )
→ Mn2++NO3-+H2O。下列叙述中正确的是( )
| A.该反应中NO2-是还原剂 |
| B.反应过程中溶液的pH 减小 |
| C.生成1 mol NaNO3时消耗2.5 mol KMnO4 |
D. 中的粒子是OH- 中的粒子是OH- |