题目内容
下列变化需要加入适当的氧化剂才能实现的是
A.CuO Cu Cu | B.Fe2+ Fe Fe | C.H2SO4 SO2 SO2 | D.HCl Cl2 Cl2 |
D
解析试题分析:在物质的变化时需要加入适当的氧化剂才能实现,说明该物质在反应中作还原剂,失去电子,物质所含有的元素的化合价升高。A.CuO Cu元素的化合价降低。错误。B.Fe2+
Cu元素的化合价降低。错误。B.Fe2+ Fe元素的化合价降低。错误。C.H2SO4
Fe元素的化合价降低。错误。C.H2SO4 SO2元素的化合价降低。错误。D.HCl
SO2元素的化合价降低。错误。D.HCl Cl2元素的化合价升高。正确。
Cl2元素的化合价升高。正确。
考点:考查氧化还原反应中的电子转移和化合价的关系。

 应用题作业本系列答案
应用题作业本系列答案某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物的质量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质量为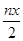 mol mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
下列变化不属于氧化还原反应的是
| A.加热氢氧化铁固体 | B.金属钠露置于空气中 |
| C.铜丝放入浓硫酸中并加热 | D.将氯气通入冷的消石灰浊液中 |
已知:2BrO3- +Cl2=Br2 +2ClO3-;5Cl2 +I2 +6H2O=2HIO3 +10HCl;ClO3-+5Cl-+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序为
| A.BrO3->ClO3->IO3->Cl2 | B.BrO3->Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->ClO3->IO3- |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2。他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)( )
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为( )
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
| A.0.008889 | B.0.08000 | C.0.1200 | D.0.2400 |
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO 3Cu+N2+3H2O,对此反应的分析合理的是( )
3Cu+N2+3H2O,对此反应的分析合理的是( )
| A.该反应属置换反应 |
| B.CuO是氧化剂 |
| C.反应体现了金属铜的还原性 |
| D.每生成1molH2O就伴随着1mol电子转移 |
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式是(未
配平):MnO4-+NO2-+ → Mn2++NO3-+H2O。下列叙述中正确的是( )
→ Mn2++NO3-+H2O。下列叙述中正确的是( )
| A.该反应中NO2-是还原剂 |
| B.反应过程中溶液的pH 减小 |
| C.生成1 mol NaNO3时消耗2.5 mol KMnO4 |
D. 中的粒子是OH- 中的粒子是OH- |
某溶液中Cl-、Br-、I-三者物质的量之比是2∶3∶4,通入一定量的Cl2,该比值为1∶1∶1,则反应的Cl2和原溶液中I-的物质的量之比是 ( )
| A.1∶2 | B.1∶4 | C.1∶6 | D.1∶8 |