题目内容
已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为( )
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |
A
解析试题分析:反应1中还原剂SO2 被氧化化合价升高,则NaClO3 中的Cl的化合价(+5)应该降低;反应2中氧化剂是Cl2,被还原化合价降低,所以还原剂亚氯酸钠的Cl的化合价(+3)应该升高,由于两个反应中产生物质均含有X,由此可知生成的X化合物中含有的Cl元素的化合价处在3—5之间,即为+4价,所以满足要求的只有A中的ClO2 ,所以A正确,故选A。
考点:本题考查的是氧化还原反应。

已知:2BrO3- +Cl2=Br2 +2ClO3-;5Cl2 +I2 +6H2O=2HIO3 +10HCl;ClO3-+5Cl-+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序为
| A.BrO3->ClO3->IO3->Cl2 | B.BrO3->Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->ClO3->IO3- |
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式是(未
配平):MnO4-+NO2-+ → Mn2++NO3-+H2O。下列叙述中正确的是( )
→ Mn2++NO3-+H2O。下列叙述中正确的是( )
| A.该反应中NO2-是还原剂 |
| B.反应过程中溶液的pH 减小 |
| C.生成1 mol NaNO3时消耗2.5 mol KMnO4 |
D. 中的粒子是OH- 中的粒子是OH- |
一定量的CuS和Cu2S的混合物投人足量的硝酸中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量的NaOH溶液,产生蓝色沉淀,过滤,洗涤,灼烧,得到24.0 g CuO。若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
| A.18.0 L | B.27.0 L | C.31.4L | D.33.6 L |
1 mo1Cu2S与2 mol FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、
CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为 ( )
| A.4 mo1 | B.5 mo1 | C.6 mo1 | D.7 mo1 |
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。淀粉KI溶液中通入SO2气体,溶液无明显变化。则下列分析中正确的是
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀 |
| C.通入SO2时,SO2与I—反应,I—作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
某溶液中Cl-、Br-、I-三者物质的量之比是2∶3∶4,通入一定量的Cl2,该比值为1∶1∶1,则反应的Cl2和原溶液中I-的物质的量之比是 ( )
| A.1∶2 | B.1∶4 | C.1∶6 | D.1∶8 |
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化磷的物质的量是( )
A.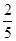 mol mol | B. mol mol | C.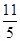 mol mol | D.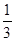 mol mol |
在xR2++yH++O2= mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是( )
| A.m="4" R2+是氧化产物 | B.m="y" R3+是氧化产物 |
| C.m="2" R3+是还原产物 | D.m="y" R3+是还原产物 |