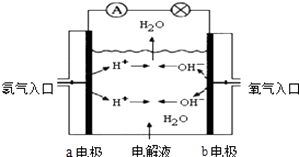
题目内容
【题目】在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )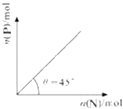
A.平衡时N的转化率为50%
B.当温度升高后,则图中θ>45°
C.若再加入N,则正、逆反应速率均逐渐增大
D.若在加入N,则反应体系中气体密度减小
【答案】A
【解析】解:A、根据图象结合方程式知,加入的N物质的物质的量与生成P物质的物质的量相等,所以该反应中有一半的N物质反应,所以其转化率为50%,故A正确;
B、反应为放热反应,升温平衡逆向移动,则P的物质的量减少,由图可以看出,图中θ<45°,故B错误;
C、因体积可变,再加入N,容器体积增大,Q浓度减小,逆反应速率减慢,故C错误;
D、根据图象结合方程式知,加入的N物质的物质的量与生成P物质的物质的量相等,所以该反应中有一半的N物质反应.
假设加入的N物质是nmol,其中有一半的N参加反应.
M(s)+2N(g)4P(s)+Q(g)
1 2 4 1![]() nmol
nmol ![]() nmol nmol
nmol nmol ![]() nmol
nmol
设M的摩尔质量和N的摩尔质量为MA、MB .
达平衡时,混合气体的ρ= ![]() =
= ![]() =
= ![]() .
.
根据密度公式知,气体的密度与加入N的多少无关,只要温度压强不变,气体摩尔体积不变,所以若再加入N,则再次达到平衡时反应体系气体密度始终不变,故D错误;
故选A.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.