题目内容
17.某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.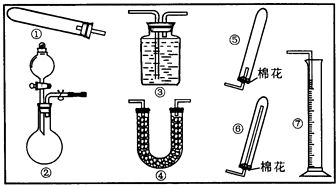
(1)若用装置①制取NH3,其反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
若要测定生成的NH3的体积,则必须选择的装置是③⑦(填装置序号),装置中所盛试剂应具有的性质是氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是CaO或(NaOH或碱石灰),分液漏斗中装的试剂是浓氨水(或浓NH4Cl溶液),收集装置应选择⑥(填装置序号).
证明氨气已收集满的操作是用湿润的红色石蕊试纸靠近管口,若试纸变蓝则证明已收集满
检验装置②的气密性的方法是在橡胶管处接上导气管,关闭分液漏斗活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),导气管末端有气泡冒出,移开热毛巾(或停止加热)一段时间,导气管末端有一段水柱(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好)
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积
(标准状况)如下表:
| 试剂组合/NH3体积(mL) | 6.0gCa(OH)2(s,过量) | 6.0NaOH(s,过量) | 6.0g CaO(s,过量) |
| 5.4g NH4Cl(s) | ①/1344 | ②/1568 | ③/1792 |
| 5.4(NH4)2SO4(s) | ④1364 | ⑤1559 | ⑥/1753 |
分析 (1)该装置属于固体加热型,所以制取的氨气应该是加热固体制取的;
要测定氨气的体积,可以采用排液体的方法测量,且氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发;
(2)浓氨水易挥发,浓氨水滴入到生石灰,与水反应生成氢氧化钙,放出大量的热,能够促进氨水的挥发;或者利用氢氧化钙与固体氯化铵加热制备氨气;
氨气密度小于空气,应选择向下排气法收集,氨气为碱性气体,遇到湿润的红色石蕊试纸变蓝,据此可以检验氨气是否收集满;
检验装置的气密性时,首先至少一端用水封闭装置内的气体,然后利用加热、降温、加压等方法使被封闭气体的压强发生变化,依据出现的现象判断是否气密;
(3)依据氮元素守恒计算生成氨气物质的量,5.4g NH4Cl(s)物质的量=$\frac{5.4g}{53.5g/mol}$=0.1mol,5.4g (NH4)2SO4(s)物质的量=$\frac{5.4g}{132g/mol}$=0.04mol,结合产率=$\frac{实际产量}{理论产量}$×100%计算分析.
解答 解:(1)该装置适用于加热固体制取气体,所以可以用加热氯化铵和氢氧化钙制取氨气,
反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
要测定氨气的体积,可以采用排液体的方法测量,所以应选择③⑦,且氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;③⑦;氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发;
(2)浓氨水易挥发,浓氨水滴入到生石灰,与水反应生成氢氧化钙,放出大量的热,能够促进氨水的挥发,可以用来制备氨气,氨气密度小于空气,应选择向下排气法收集,所以应选择⑥,氨气为碱性气体,遇到湿润的红色石蕊试纸变蓝,据此可以检验氨气是否收集满;
检验②气密性方法:在橡胶管处接上导气管,关闭分液漏斗活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),导气管末端有气泡冒出,移开热毛巾(或停止加热)一段时间,导气管末端有一段水柱(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好);
故答案为:CaO或(NaOH或碱石灰);浓氨水(或浓NH4Cl溶液);⑥;用湿润的红色石蕊试纸靠近管口,若试纸变蓝则证明已收集满;
在橡胶管处接上导气管,关闭分液漏斗活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),导气管末端有气泡冒出,移开热毛巾(或停止加热)一段时间,导气管末端有一段水柱(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好);
(3)依据氮元素守恒计算生成氨气物质的量,5.4g NH4Cl(s)物质的量=$\frac{5.4g}{53.5g/mol}$=0.1mol,5.4g (NH4)2SO4(s)物质的量=$\frac{5.4g}{132g/mol}$=0.04mol,结合产率=$\frac{实际产量}{理论产量}$×100%计算分析:
①Ca(OH)2 NH4Cl反应实验室制氨气的产率=$\frac{1.344L}{\frac{22.4L/mol}{0.1mol}}$×100%=60%;
②NaOH NH4Cl(s)反应实验室制氨气的产率=$\frac{1.568L}{\frac{22.4L/mol}{0.1mol}}$×100%=70%;
③CaO NH4Cl反应实验室制氨气的产率=$\frac{\frac{1.792L}{22.4L/mol}}{0.1mol}$×100%=80%;
④Ca(OH)2(NH4)2SO4,反应实验室制氨气的产率=$\frac{1.364L}{\frac{22.4L/mol}{0.08mol}}$×100%=76%;
⑤NaOH(NH4)2SO4,反应实验室制氨气的产率=$\frac{1.559L}{\frac{22.4L/mol}{0.08mol}}$×100%=87%;
⑥CaONH4)2SO4,反应实验室制氨气的产率=$\frac{\frac{1,753L}{22.4L/mol}}{0.08mol}$×100%=97.8%;
所以生成氨气的产率最高的是⑥,原因是因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高;
故答案为:⑥;因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高.
点评 本题考查了氨气制备方法,装置和原理的分析应用,反应过程中产率的计算判断和原因分析,熟悉氨气制备原理和氨气的性质是解题关键,题目难度中等.

| A. | 聚氯乙烯一次性超薄袋可用于包装食品 | |
| B. | 利用电渗析法和离子交换法能获得纯净水 | |
| C. | 体积分数为95%的酒精用作医用酒精 | |
| D. | 石油裂化的目的是得到乙烯、丙烯等化工原料 |
| A. | 大于零即可 | B. | 大于0.6mol | C. | 大于或等于1mol | D. | 任意值 |
| A. | 0.1mol-NH2(氨基)中含有的电子数目为1.0NA | |
| B. | 常温下,1L 0.1mol•L-1 CH3COONa溶液中含有阴离子总数大于0.1NA | |
| C. | 标准状况下,2.24 LH2O中含有的原子总数大于0.3NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
| A. | 从结构上推断,木糖分子中有多个羟基,因而能溶于水 | |
| B. | 木糖属于单糖 | |
| C. | 木糖属还原性糖,1mol木糖与足量的银氨溶液完全反应可生成108g银 | |
| D. | 木糖能发生酯化、氧化、加成等反应 |
| A. | 实验室制备用盐酸制H2,可用排饱和碳酸氢钠溶液除氯化氢 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入硝酸钠固体,铜粉仍不溶 | |
| C. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| D. | Cl2具有很强的氧化性,但在化学反应中可能作还原剂 |