题目内容
9.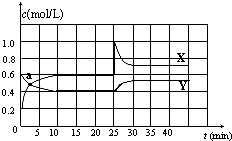 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | a点时v(N2O4)=v(NO2) | |
| C. | 25min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强 | |
| D. | 前10min内用v(N2O4)表示的化学反应速率为0.02 mol/(L•min) |
分析 由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.
A、计算X、Y的浓度变化量,利用浓度变化量之比等于化学计量数之比,确定表示NO2浓度变化曲线;
B、a点时c(N2O4)=c(NO2);
C、除改变是将密闭容器的体积缩小,增大压强,也可能通过改变温度的方法;
D、由图象可知,10 min内用N2O4的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,根据v=$\frac{△c}{△t}$计算v(N2O4).
解答 解:由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.
A、由上述分析可知,X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,故A正确;
B、a点时c(N2O4)=c(NO2),而不是率相等,故B错误;
C、除改变是将密闭容器的体积缩小,增大压强,也可能通过改变温度的方法,不只是缩小体积,故C错误;
D、由图象可知,10 min内用N2O4的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,故v(N2O4)=$\frac{0.2mol/L}{10min}$=0.02mol/(L•min),故D正确;
故选BC.
点评 本题考查化学反应速率及化学平衡图象,注意把握曲线的变化趋势,正确判断外界条件对平衡移动的影响,明确图象中纵横坐标及点、线、面的意义,难度中等.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| B. | 稀盐酸与氢氧化钡溶液反应:H++OH-=H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| D. | 稀硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=Ba SO4↓+H2O |
| A. | 可能同周期,也可能同主族 | B. | 若一种是F,另一种肯定是Na | ||
| C. | 若一种是Mg,另一种只能是硅 | D. | 一定同周期,不可能同主族 |
| A. | 等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2++2Br- $\frac{\underline{\;电解\;}}{\;}$Cu+Br2 | |
| B. | Na2S溶液水解:S2-+2H2O?H2S+2OH- | |
| C. | Fe(NO3)3的酸性溶液中通入足量硫化氢:2Fe3++H2S=2Fe2++S↓+2H+ | |
| D. | H218O中投入Na2O2:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
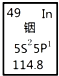
| A. | 铟元素的质量数是114.8 | |
| B. | 铟元素的相对原子质量是114 | |
| C. | 铟原子最外层有3个能量相同的电子 | |
| D. | 铟元素是一种主族元素 |
| A. | 采用酸碱中和滴定法测定 | |
| B. | 与足量Zn反应,测量生成的H2体积 | |
| C. | 与足量AgNO3溶液反应,称量生成的AgCl质量 | |
| D. | 与足量CaCO3反应,测量生成的CO2质量 |
(1)下表是元素周期表的一部分,根据表中给出的8种元素,用元素符号或化学式回答下列问题:
| 周期族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | A | B | C | D | ||||
| 3 | E | F | G | H |
②元素最高价氧化物对应水化物中,酸性最强的是HClO4.
③B与C两元素的气态氢化物,热稳定性较强的是第三周期VA族.
(2)四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
| X | ||
| Y | Z | W |
①元素Z位于周期表中第三周期VA 族.
②Y元素的原子结构示意图为
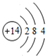 .
.③元素X的气态氢化物与元素W的最高价氧化物对应水化物反应的生成物中化学键的类型是离子键、共价键.
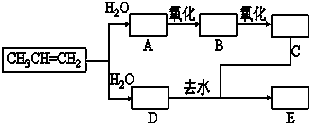 已知:①丙烯与水进行加成反应,其可能的产物有两种;②图中E为开链的酯类化合物,其分子式为C6H12O2.
已知:①丙烯与水进行加成反应,其可能的产物有两种;②图中E为开链的酯类化合物,其分子式为C6H12O2.