题目内容
4.下列离子方程式正确的是( )| A. | 等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2++2Br- $\frac{\underline{\;电解\;}}{\;}$Cu+Br2 | |
| B. | Na2S溶液水解:S2-+2H2O?H2S+2OH- | |
| C. | Fe(NO3)3的酸性溶液中通入足量硫化氢:2Fe3++H2S=2Fe2++S↓+2H+ | |
| D. | H218O中投入Na2O2:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
分析 A.阴极上阳离子氧化性强的铜离子先得到电子,阴极上还原性强的溴离子失去电子;
B.硫离子水解分步进行,以第一步为主;
C.硫化氢足量,酸性溶液中,氧化性HNO3>Fe3+,则Fe(NO3)3完全反应;
D.Na2O2为氧化剂,也为还原剂.
解答 解:A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生的离子反应为Cu2++2Br- $\frac{\underline{\;电解\;}}{\;}$Cu+Br2,故A正确;
B.Na2S溶液水解的离子反应为S2-+H2O?HS-+OH-,故B错误;
C.因硫化氢足量,则Fe(NO3)3完全反应,离子反应为Fe3++3NO3-+2H++5H2S═Fe2++3NO↑+6H2O+5S↓,故C错误;
D.H218O中投入Na2O2:的离子反应为2H218O+2Na2O2=4Na++2OH-+218OH-+O2↑,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重电解、水解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒分析,综合性较强,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.决定一定物质的量气体体积大小的主要因素是( )
| A. | 气体分子的大小 | B. | 气体分子的质量 | ||
| C. | 气体分子间距离的大小 | D. | 气体分子的组成 |
15. 喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )
喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )
 喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )
喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )| 气 体 | 液 体 | 气 体 | 液 体 | ||
| A | HCl | 蒸馏水 | B | SO2 | 浓烧碱液 |
| C | NO | 浓烧碱液 | D | NH3 | 蒸馏水 |
| A. | A | B. | B | C. | C | D. | D |
12.有关核电荷数为1~18的元素,下列叙述中正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素不一定是金属元素 | |
| D. | 核电荷数为17的元素的原子易获得1个电子 |
9.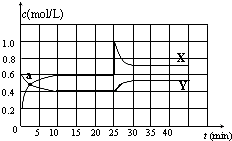 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | a点时v(N2O4)=v(NO2) | |
| C. | 25min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强 | |
| D. | 前10min内用v(N2O4)表示的化学反应速率为0.02 mol/(L•min) |
16.下列说法中,不正确的是( )
| A. | SO2(g)+0.5O2(g)?SO3(g)△H=-213kJ•mol-1 说明25℃,101kPa下,lmolSO2与0.5mol氧气放入密闭容器中生成SO3时放出213 kJ热量 | |
| B. | 若反应物总能量高于生成物总能量,反应放热,△H<0 | |
| C. | 化学反应必然伴随能量变化 | |
| D. | 酸和碱的中和反应都是放热反应 |
14.X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,它们在周期表中的相对位置如表;X元素最低负化合价的绝对值与其原子最外层电子数相等;Z是地壳中含量最多的金属元素
(1)元素Q在周期表中的位置是第三周期ⅥA族,Z的离子结构示意图为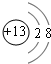 .
.
(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为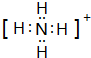 .
.
(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
| X | Y | ||
| Z | W | Q |
 .
.(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为
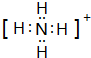 .
.(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
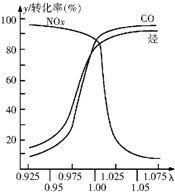 随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.
随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.