题目内容
17.短周期两种元素,它们的原子序数相差2,则( )| A. | 可能同周期,也可能同主族 | B. | 若一种是F,另一种肯定是Na | ||
| C. | 若一种是Mg,另一种只能是硅 | D. | 一定同周期,不可能同主族 |
分析 短周期元素的原子序数相差2,可能为同周期的元素,如C与O,也可能为同一主族元素,如Li与H,可能即不同周期也不同主族,如Na与F,以此来解答.
解答 解:A.可能为同周期的元素,如C与O;若短周期元素分别为Li与H,原子序数相差2,二者位于同一主族,故A正确;
B.若短周期元素,Na是11号,而F是9号元素,它们的原子序数相差2;也可以是F和N,故B错误;
C.若短周期元素,Mg是12号,而硅是14号元素,它们的原子序数相差2,但也可以是10号元素氖,故C错误;
D.两种元素不一定处于同一周期,如钠元素和氟元素,可能是同主族如Li与H,故D错误;
故选A.
点评 本题考查元素周期表由元素周期律的综合应用,侧重于学生的分析能力的考查,为高考常见题型,熟悉常见元素的位置,利用列举法进行解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.向明矾溶液中滴入Ba(OH)2溶液时,当SO42-沉淀完全时,铝元素的存在形式是( )
| A. | 一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中 | |
| B. | 一部分为Al(OH)3沉淀,一部分以-形式存在于溶液中 | |
| C. | 全部为Al(OH)3沉淀 | |
| D. | 几乎全部以AlO2-存在于溶液中 |
5. 一定温度下,在容积为2L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,则下列表述中正确的是( )
一定温度下,在容积为2L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,则下列表述中正确的是( )
 一定温度下,在容积为2L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,则下列表述中正确的是( )
一定温度下,在容积为2L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,则下列表述中正确的是( )| A. | 该反应的化学方程式为2M?N | |
| B. | t2时,正、逆反应速率相等,达到平衡 | |
| C. | t2时,用M表示的反应速率为$\frac{1}{{t}_{2}}$mol•L-1•min-1 | |
| D. | t3时,每生成1mol M的同时会生成1mol N |
12.有关核电荷数为1~18的元素,下列叙述中正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素不一定是金属元素 | |
| D. | 核电荷数为17的元素的原子易获得1个电子 |
2.下列过程中所发生的化学变化属于取代反应的是( )
| A. | 乙烯通入溴水中 | |
| B. | 光照射甲烷与氯气的混合气体 | |
| C. | 在镍作催化剂的条件下,苯与氢气反应 | |
| D. | 乙醇与酸性重铬酸钾溶液反应 |
9.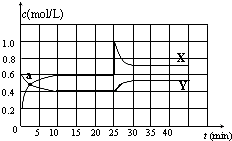 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | a点时v(N2O4)=v(NO2) | |
| C. | 25min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强 | |
| D. | 前10min内用v(N2O4)表示的化学反应速率为0.02 mol/(L•min) |
6.对于Na+、Mg2+、Al3+三种离子,下列说法不正确的是( )
| A. | 核外电子层数相同 | B. | 半径大小顺序Na+<Mg2+<Al3+ | ||
| C. | 核外电子数相同 | D. | 最外层电子数相同 |
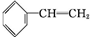 +Br2→
+Br2→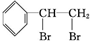 ,反应类型是加成反应.
,反应类型是加成反应. .
.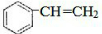 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$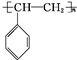 .
.