题目内容
19.元素在周期表中的位置,反映了元素的原子结构和元素的性质.(1)下表是元素周期表的一部分,根据表中给出的8种元素,用元素符号或化学式回答下列问题:
| 周期族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | A | B | C | D | ||||
| 3 | E | F | G | H |
②元素最高价氧化物对应水化物中,酸性最强的是HClO4.
③B与C两元素的气态氢化物,热稳定性较强的是第三周期VA族.
(2)四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
| X | ||
| Y | Z | W |
①元素Z位于周期表中第三周期VA 族.
②Y元素的原子结构示意图为
 .
.③元素X的气态氢化物与元素W的最高价氧化物对应水化物反应的生成物中化学键的类型是离子键、共价键.
分析 (1)由元素在周期表中位置,可知A为碳、B为O、C为氟、D为Ne、E为Na、F为Mg、G为Al、H为Cl.
①稀有气体化学性质最不活泼;碳元素形成化合物种类最多;同周期自左而右原子半径减小,同主族自上而下原子半径增大;
②元素最高价氧化物对应水化物中,酸性最强的是高氯酸;
③非金属性越强,对应氢化物越稳定;
(2)由短周期元素的位置可知,X处于第二周期,Y、Z、W处于第三周期,Z元素原子核外电子总数是其最外层电子数的3倍,设最外层电子数为x,故2+8+x=3x,解得x=5,故Z为P,可推知X为N、Y为Si、W为S.
①主族元素周期数=电子层数,主族族序数=最外层电子数;
②Y为Si,原子核外有14个电子,有3个电子层,各层电子数为2、8、4;
③元素X的气态氢化物为NH3,元素W的最高价氧化物对应水化物为H2SO4,二者反应生成(NH4)2SO4.
解答 解:(1)由元素在周期表中位置,可知A为碳、B为O、C为氟、D为Ne、E为Na、F为Mg、G为Al、H为Cl.
①稀有气体Ne原子最外层为稳定结构,化学性质最不活泼;碳元素形成化合物种类最多;同周期自左而右原子半径减小,同主族自上而下原子半径增大,故Na原子半径最大,故答案为:Ne;C;Na;
②元素最高价氧化物对应水化物中,酸性最强的是HClO4,故答案为:HClO4;
③非金属性F>O,非金属性越强,对应氢化物越稳定,即HF较稳定,故答案为:HF;
(2)由短周期元素的位置可知,X处于第二周期,Y、Z、W处于第三周期,Z元素原子核外电子总数是其最外层电子数的3倍,设最外层电子数为x,故2+8+x=3x,解得x=5,故Z为P,可推知X为N、Y为Si、W为S.
①Z为P元素,处于第三周期VA族,故答案为:三;VA;
②Y为Si,原子核外有14个电子,有3个电子层,各层电子数为2、8、4,原子结构示意图为 ,故答案为:
,故答案为: ;
;
③元素X的气态氢化物为NH3,元素W的最高价氧化物对应水化物为H2SO4,二者反应生成(NH4)2SO4,含有离子键、共价键,故答案为:离子键、共价键.
点评 本题考查元素周期表与元素周期律,比较基础,有利于基础知识的巩固.

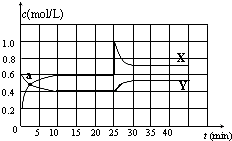 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | a点时v(N2O4)=v(NO2) | |
| C. | 25min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强 | |
| D. | 前10min内用v(N2O4)表示的化学反应速率为0.02 mol/(L•min) |
| 实验操作 | 实验目的 | |
| A | 向NaBr溶液中滴加新制氯水 | 比较Cl2与Br2的氧化性强弱 |
| B | 用同一电路分别测定盐酸和某一元酸溶液的导电性 | 比较盐酸和该一元酸酸性的强弱 |
| C | 分别向AlCl3溶液和MgCl2溶液中加入过量NaOH溶液 | 比较镁与铝的金属性强弱 |
| D | 常温下测定同浓度Na2CO3溶液和Na2SO4溶液的pH值 | 比较硫和碳的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
| X | Y | ||
| Z | W | Q |
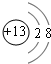 .
.(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为
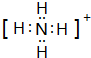 .
.(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
| A. | 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 | |
| C. | 金属钾的晶胞空间利用率大于金属钋的晶胞空间利用率 | |
| D. | 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构 |
| A. | 氯化钠溶液中滴入硝酸银溶液 | B. | 碳在氧气中燃烧 | ||
| C. | 铁片置于硫酸铜溶液中 | D. | 氢氧化钠溶液与稀硫酸反应 |
| A. | 用托盘天平称取3.23 g NaCl固体 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 分液以后 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | |
| D. | 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 |
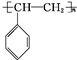
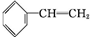 +Br2→
+Br2→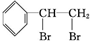 ,反应类型是加成反应.
,反应类型是加成反应. .
.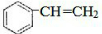
 .
.