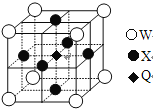
题目内容
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
![]()
则x= 。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) ![]() HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时v(HCOOCH3)= 。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) = 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正) v(逆)(填“﹥”“﹤”“﹦”),原因是 。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“﹥”“﹤”“﹦”),判断的理由是 。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
NO+CO![]() N2+ CO2(有CO) 2NO
N2+ CO2(有CO) 2NO![]() N2+ O2(无CO)
N2+ O2(无CO)
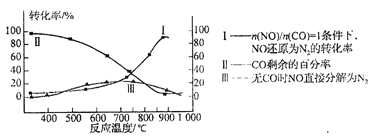
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 。
②在n(NO)/ n(CO)=1的条件下,应控制最佳温度在 左右。
【答案】
(1)1076
(2)①Ⅱ中使用催化剂 ②0.10 mol·L-1·min-1 ③2 L·mol-1 ﹤ 浓度商Qc=1.5/(0.5·1)=3﹥2=K 反应向逆方向进行,故v(正) ﹤v(逆) ④﹥此反应为放热反应,降温,平衡向正向进行(或反应Ⅰ达平衡时所需的时间比反应Ⅲ达平衡时所需的时间短,反应速率快,故T1温度更高)
(3)①此反应为放热反应,升高温度反应更有利于向逆反应方向进行 ②870(或850~900之间都可以)
【解析】
试题分析:
(1)反应物断键共吸收热量(x + 436×2),生成物成键共放出热量(413×3+343+465)。则有ΔH=(x + 436×2)-(413×3+343+465)=-99kJ·mol-1,计算可得x=1076;
(2)①该反应为气体系数减小的放热反应。Ⅱ和Ⅰ相比,先达到化学平衡,但平衡时体系的总压强没有改变,说明平衡未发生移动,因此改变的条件为加入正催化剂。
②相同的温度和体积之下,压强之比等于物质的量之比,可得反应后各物质的总物质的量为3mol,根据三段式或差量法可得生成的HCOOCH3为1mol,则可得v(HCOOCH3)=0.10 mol·L-1·min-1
③平衡常数![]() , 浓度商Qc=1.5/(0.5·1)=3﹥2=K 反应向逆方向进行,故v(正) ﹤v(逆)
, 浓度商Qc=1.5/(0.5·1)=3﹥2=K 反应向逆方向进行,故v(正) ﹤v(逆)
④反应Ⅰ达平衡时所需的时间比反应Ⅲ达平衡时所需的时间短,反应速率快,故T1温度更高
(3)①此反应为放热反应,升高温度反应更有利于向逆反应方向进行
②由图像可知850~900之间NO转化率较高。