题目内容
【题目】I.实验室制备、收集干燥的 SO2,所需仪器如下图。
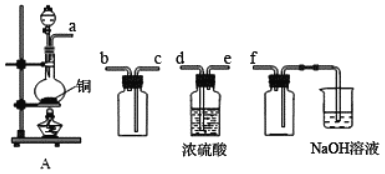
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为 a→___→___→___→___→f。
(2)验证产生的气体是 SO2的方法及实验现象是_________________________________。
(3)若在1 L 0.3 mol/L的 NaOH溶液中,通入4.48 L SO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+ c(H+)= c(HSO3-)+2 c(SO32-)+ c(OH-),请再写出两个等量关系: ________________。
II.SO2 气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:
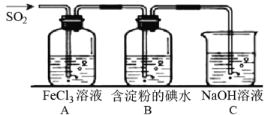
(4)若要从FeCl3溶液中提取晶体,必须进行的实验操作步骤中没有用到的玻璃仪器有_________。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(5)装置 A 中的现象是_________________,写出 B 中发生反应的离子方程式:___________________。
(6)在上述装置中通入过量的 SO2,为了验证A中SO2与 Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入 KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是________。
【答案】
(1)d→e→c→b;
(2)将气体通入品红溶液,溶液褪色,加热恢复原色;
(3)2c(Na+) =3[c(SO32-)+ c(HSO3-)+ c(H2SO3)]
c(SO32-)+ c(HSO3-)+ c(H2SO3)=0.2mol/L
c(HSO3-)+3 c(H2SO3)+2 c(H+)= c(SO32-)+2 c(OH-)
(4)b
(5)溶液颜色由黄色逐渐变为浅绿色;I2+SO2+2H2O = 2I-+SO42-+4H+
(6)①
【解析】
试题分析:(1)收集二氧化硫应先干燥再收集,故先通过d、e,二氧化硫的密度比空气大,要从c口进气,b口出来进行尾气处理.因为二氧化硫易于氢氧化钠反应,故f的作用是安全瓶,防止倒吸;盛放NaOH溶液的烧杯为尾气处理装置要放置在最后;故答案为:d;e;c;b;
(2)检验二氧化硫的一般方法是将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫,故答案为:将气体通入品红溶液中,如果品红褪色,加热后又恢复红色;
(3)n(NaOH)=0.3mol/L×1L=0.3mol,n(SO2)=![]() =0.2mol,设生成Na2SO3、NaHSO3的物质的量分别是xmol、ymol,根据Na、S原子守恒得x+y=0.22x+y=0.3解得,x=0.1mol,y=0.1mol,所以溶液中的溶质是等物质的量的Na2SO3、NaHSO3,溶液中存在电荷守恒、物料守恒和质子守恒,根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),根据物料守恒得2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),]),[SO32-]+[HSO3-]+[H2SO3]=0.2mol/L,根据质子守恒得c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-),故答案为:2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),[SO32-]+[HSO3-]+[H2SO3]=0.2mol/L或c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-);
=0.2mol,设生成Na2SO3、NaHSO3的物质的量分别是xmol、ymol,根据Na、S原子守恒得x+y=0.22x+y=0.3解得,x=0.1mol,y=0.1mol,所以溶液中的溶质是等物质的量的Na2SO3、NaHSO3,溶液中存在电荷守恒、物料守恒和质子守恒,根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),根据物料守恒得2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),]),[SO32-]+[HSO3-]+[H2SO3]=0.2mol/L,根据质子守恒得c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-),故答案为:2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),[SO32-]+[HSO3-]+[H2SO3]=0.2mol/L或c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-);
(4)操作步骤:蒸发需用到酒精灯、蒸发皿、玻璃棒,冷却结晶需用到烧杯,过滤需用到漏斗、烧杯、玻璃棒,故不需要B.烧瓶,故答案为:B;
(5)装置 A 中反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,溶液颜色由黄色逐渐变为浅绿色;B 中二氧化硫与碘水反应生成氢碘酸和硫酸,发生反应的离子方程式为I2+SO2+2H2O = 2I-+SO42-+4H+,故答案为:溶液颜色由黄色逐渐变为浅绿色;I2+SO2+2H2O = 2I-+SO42-+4H+;
(6)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以不合理的是方案①,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色,故答案为:①;

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案