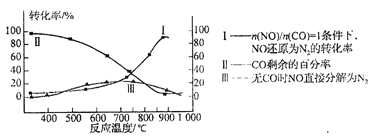
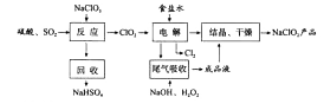
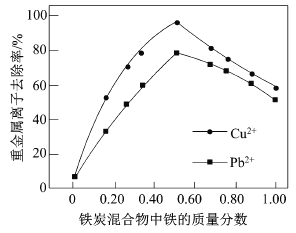
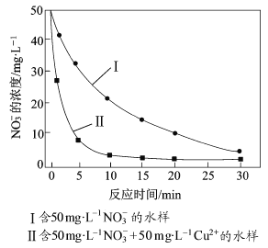
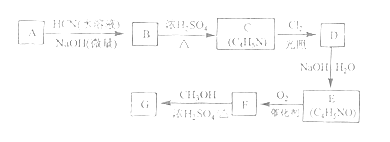
题目内容
【题目】已知Q、R、X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中Q原子外层电子数是内层电子数的两倍;化合物R2Z的晶体为离子晶体,Z原子核外的M层中有两对成对电子;X元素最外层电子数与最内层电子数相同;Y单质的晶体类型在同周期的单质中没有相同的;W元素所在族有三列,只有两个未成对的电子。请根据以上信息,回答下列问题:(答题时,Q、R、X、Y、Z、W用所对应的元素符号表示)
(1)W的外围电子(价电子)排布式是 。
(2)Q、R、X、Y的第一电离能由小到大的顺序为_ 。(用元素符号表示)
(3)QZ2分子的空间构型为 形。
(4)R的氯化物的熔点比Y的氯化物的熔点_ _(填高或低),理由是_ _ 。
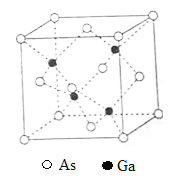
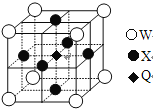
(5)据报道,只含Q、X、W三种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构如图,试写出该晶体的化学式_ 。晶体中每个X原子周围距离最近的W原子有__ _个。
【答案】
(1)3d8s2
(2)Na、Mg、Si、C
(3)直线型
(4)高 ,NaCl是离子晶体、SiCl4是分子晶体
(5) ![]() ,4
,4
【解析】
试题分析: Q原子外层电子数是内层电子数的两倍,Q是C碳元素; Z原子核外的M层中有两对成对电子, Z是S元素;X元素最外层电子数与最内层电子数相同,X是Mg元素;Y单质的晶体类型在同周期的单质中没有相同的,Y是Si属于原子晶体;W元素所在族有三列,为第Ⅷ族,只有两个未成对的电子,W是Ni元素;化合物R2Z的晶体为离子晶体,R为+1价,R是Na元素。
(1)W的外围电子(价电子)排布式是3d8s2。
(2)C、Na、Mg、Si,Mg的3s2处于全满状态,第一电离能比其左右都大,第一电离能由小到大的顺序为Na、Mg、Si、C
(3)CS2中C原子杂化方式SP,分子的空间构型为直线型。
(4) NaCl是离子晶体、SiCl4是分子晶体,NaCl的熔点比SiCl4的氯化物的熔点高。
(5)(5)利用均摊法确定Q原子个数是1、X原子个数是3、W原子个数是1,该晶体的化学式是![]() 。晶体中每个X原子周围距离最近的W原子有4个。
。晶体中每个X原子周围距离最近的W原子有4个。