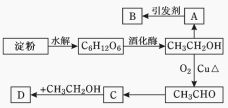
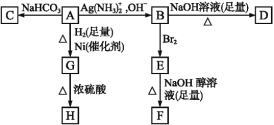
题目内容
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30 mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
① 能否各取少许固体用舌头品尝?_____。(选填“能”或“不能”)
② 用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有___性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置如图所示。

已知:2NO2+2NaOH=NaNO2+NaNO3+H2O。
① 写出装置I中发生反应的化学方程式___________________________________。
② 水_______(选填“能"或“不能”)作为装置II中的试剂,理由是_________________。
③ 装置III中反应完全后,接下来的操作是_________________________________。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_______(选填“增多”、“减少"或“不变”),原因可能是______________(用化学方程式解释)。
【答案】(1)①不能(1分)②氧化(1分)(2)①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+ 2H2O(2分)
②不能(1分);NO2与水反应生成NO,会污染空气(1分) ③先打开a,再关闭b(1分)
(3)减小(1分),2NaNO2+O2=2NaNO3(2分)
【解析】
试题分析:(1)①任何化学试剂都不能用舌头品尝;
②能使淀粉、KI溶液变蓝,说明碘离子被氧化为单质碘,因此说明亚硝酸钠较强氧化性;
(2)①Ⅰ装置中产生二氧化氮,反应的方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+ 2H2O。
②NO2与水反应能产生一氧化氮,排到空气中会造成污染,所以水不能作为装置Ⅱ中的试剂;
③装置Ⅲ中反应完全后,要将Ⅰ装置中产生的二氧化氮排到Ⅱ装置中,所以操作为先打开a,再关闭b;
(3)NaNO2是强碱弱酸盐,溶液呈碱性,在空气中被氧气氧化成NaNO3是强酸强碱盐,所以会使溶液的pH减小,而溶液中NaNO2的含量会减小,反应的方程式为2NaNO2+O2=2NaNO3。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案