题目内容
【题目】煤的综合利用对于改善大气质量和能源充分利用有重要的意义。
(1)下列说法正确的是 (填序号)。
a.煤是由有机物和少量无机物组成的复杂混合物
b.煤在燃烧过程中会生成一氧化碳、二氧化碳、氮氧化物、烟尘等有害物质
c.可利用生石灰、熟石灰、石灰石等固硫剂使煤在燃烧过程中生成稳定的硫酸盐
d.煤的干馏属于化学变化,煤的气化和液化都属于物理变化
(2)煤的气化过程中产生的有害气体H2S用氨水吸收生成正盐的离子方程式是
。
(3)燃煤烟气的一种脱硫方案-火碱-石灰-石膏法流程图1如下:
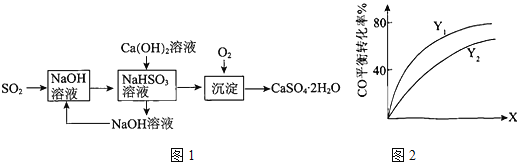
①常温下,用NaOH溶液吸收SO2得到pH=6的NaHSO3溶液,该溶液中离子浓度的大小顺序是
。
②氢氧化钙与NaHSO3反应的化学方程式是 。
(4)煤的间接液化法合成二甲醚的三步反应如下:
Ⅰ.2H2(g)+CO(g) ![]() CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1
Ⅱ.2CH3OH(g) ![]() CH3OCH3(g)+ H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H=-23.5 kJ·mol-1
Ⅲ.CO(g) + H2O(g) ![]() CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1
① 总反应热化学方程式:3H2(g)+ 3CO(g) ![]() CH3OCH3(g)+ CO2(g) △H=
CH3OCH3(g)+ CO2(g) △H=
② Y(Y1、Y2),X可分别代表压强或温度。如图2表示Y一定时,总反应中CO的平衡转化率随X的变化关系。判断Y1、Y2的大小关系,并简述理由:
。
【答案】
(1)abc
(2)H2S+2NH3·H2O==2NH4++S2-+2H2O
(3)①c(Na+)﹥c(HSO3-)﹥c(H+)﹥c(SO32-)﹥c(OH-) ②Ca(OH)2+ NaHSO3== CaSO3↓+NaOH+ H2O
(4)①-246.4 kJ·mol-1 ②Y1﹤Y2 由3H2(g)+ 3CO(g) ![]() CH3OCH3(g)+ CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表温度,压强一定时,温度越低平衡转化率越大。
CH3OCH3(g)+ CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表温度,压强一定时,温度越低平衡转化率越大。
【解析】
试题分析:
(1)a.煤是由有机物和少量无机物组成的复杂的混合物,主要含有C元素,故a正确;b.煤中伴有硫元素和氮元素,不完全燃烧时生成一氧化碳、二氧化硫、氮氧化物、烟尘等有毒物质,故b正确;c.碳酸钙受热分解为氧化钙,二氧化硫是酸性氧化物,能与氢氧化钙、氧化钙发生反应生成亚硫酸钙,然后被氧气氧化生成稳定的硫酸盐,故c正确;d.煤的干馏、煤的气化和液化都属于化学变化,故d错误;故答案为:abc。
(2)H2S用氨水吸收生成正盐硫化铵和水,离子方程式为H2S+2NH3·H2O==2NH4++S2-+2H2O,故答案为:H2S+2NH3·H2O==2NH4++S2-+2H2O;
(3)①常温下,NaHSO3溶液的pH=6,NaHSO3溶液呈酸性,据此分析:电离程度大于水解程度;故离子浓度的大小为c(Na+)﹥c(HSO3-)﹥c(H+)﹥c(SO32-)﹥c(OH-),故答案为:c(Na+)﹥c(HSO3-)﹥c(H+)﹥c(SO32-)﹥c(OH-);②氢氧化钙与NaHSO3反应生成沉淀亚硫酸钙、NaOH和水,化学方程式为Ca(OH)2+ NaHSO3== CaSO3↓+NaOH+ H2O,故答案为:Ca(OH)2+ NaHSO3== CaSO3↓+NaOH+ H2O;
(4)①题中,由盖斯定律Ⅱ+Ⅲ+Ⅰ×2得到3H2(g)+3CO(g) ![]() CH3OCH3(g)+ CO2(g) 的△H=-246.4 kJ·mol-1,故答案为:-246.4 kJ·mol-1;②3H2(g)+3CO(g)
CH3OCH3(g)+ CO2(g) 的△H=-246.4 kJ·mol-1,故答案为:-246.4 kJ·mol-1;②3H2(g)+3CO(g) ![]() CH3OCH3(g)+ CO2(g) △H﹤0,正反应气体体积减小,升高温度,平衡逆向移动,CO的平衡转化率减小,增大压强,平衡正向移动,CO的平衡转化率增大,因此X代表压强,Y代表温度;等压强条件下,温度越高,CO的平衡转化率越小,因此Y1﹤Y2,故答案为:Y1﹤Y2,由3H2(g)+ 3CO(g)
CH3OCH3(g)+ CO2(g) △H﹤0,正反应气体体积减小,升高温度,平衡逆向移动,CO的平衡转化率减小,增大压强,平衡正向移动,CO的平衡转化率增大,因此X代表压强,Y代表温度;等压强条件下,温度越高,CO的平衡转化率越小,因此Y1﹤Y2,故答案为:Y1﹤Y2,由3H2(g)+ 3CO(g) ![]() CH3OCH3(g)+ CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表温度,压强一定时,温度越低平衡转化率越大。
CH3OCH3(g)+ CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表温度,压强一定时,温度越低平衡转化率越大。