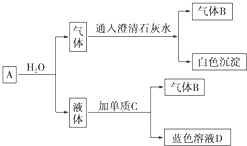
题目内容
5.煤是重要的能源也是生成化工产品的重要原料,如图1是煤化工业链的一部分.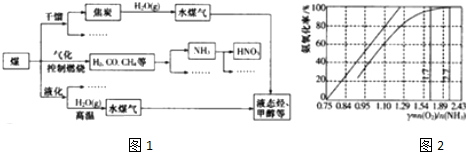
试用所学知识,解决下列问题:
(1)煤的转化技术包括煤的气化技术和煤的液化技术.煤的液化技术又分为直接液化技术和间接液化技术
(2)在煤燃烧前需对煤进行脱硫处理.煤的某种脱硫技术的原理如图2所示:
Fe2$→_{O_{2}/H_{2}O}^{在微生物作用下}$Fe2++SO${\;}_{4}^{2-}$$→_{O_{2}/H+}^{在微生物作用下}$Fe3+这种脱硫技术称为微生物脱硫技术.该技术的第一步反应的离子方程式为2FeS2+7O2+2H2O=4H++2Fe2++4SO42-,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O
(3)工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油
(4)工业上主要采用氨氧法生成硝酸,如图2是氨氧化率与氨-空气混合气中氨氧比的关系.其中直线表示反应的理论值,曲线表示实际生成情况,当氨氧化率达到100%,理论上γ$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将γ值维护在1.7-2.2之间,原因是O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%.
分析 (1)煤的液化分为直接液化和间接液化;
(2)根据化合价升降总数相等以及原子守恒来写离子方程式;
(3)工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油;
(4)根据氨氧化的化学方程式来分析;根据O2浓度对平衡的影响分析.
解答 解:(1)煤的液化分为直接液化和间接液化,故答案为:直接液化技术;间接液化技术;
(2)第一步反应中反应物有FeS2、O2和H2O,生成物有Fe2+和SO42-,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;Fe2+具有还原性,可被氧气氧化为Fe3+,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;4Fe2++O2+4H+=4Fe3++2H2O;
(3)工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油;故答案为:焦炉煤气、粗氨水、煤焦油;
(4)由氨氧化的化学方程式:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,可知氨氧化率达到100%,理论上γ{n(O2)/n(NH3)}=$\frac{5}{4}$=1.25,O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,
故答案为:1.25;O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%.
点评 本题考查煤的综合利用,涉及到氧化还原方程式的书写,题目难度中等,本题注意从题目中获取信息,结合物质的性质解答.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
15.下列四组物质,组内每种混合物都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水、酒精和水、植物油和水 | |
| B. | 四氯化碳和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙酸和乙醇、乙酸和水 | |
| D. | 水和植物油、己烷和水、苯和水 |
13.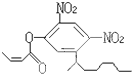 阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )
阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )
①均能与NaOH溶液反应;②遇FeCl3溶液均显紫色;③一定条件下均能与氢气发生加成反应;④均能与溴水发生加成反应.
 阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )
阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )①均能与NaOH溶液反应;②遇FeCl3溶液均显紫色;③一定条件下均能与氢气发生加成反应;④均能与溴水发生加成反应.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
20. “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )| A. | 甲物质在一定条件下可以生成有机高分子化合物 | |
| B. | 1mol乙物质可与2mol钠完全反应生成1mol氢气 | |
| C. | 甲、丙物质都能使溴的四氯化碳溶液褪色 | |
| D. | 甲在酸性条件下水解产物之一与乙互为同系物 |
10.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之积与L层的电子数相同.则下列判断不正确的是( )
| A. | 乙元素的族序数比甲元素的族序数大 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序:甲>丙 | |
| C. | 原子半径由大到小的顺序:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
17.微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O 负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+ 则有关该电池的下列说法正确的是( )
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O 负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+ 则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
14.下列排列顺序正确的是( )
①酸性:H3PO4>H2SO4>HClO4
②热稳定性:H2O>HF>H2S
③原子半径:Na>Mg>O
④还原性:S2->Cl->F-
⑤沸点:H2 Se>H2S>H2O.
①酸性:H3PO4>H2SO4>HClO4
②热稳定性:H2O>HF>H2S
③原子半径:Na>Mg>O
④还原性:S2->Cl->F-
⑤沸点:H2 Se>H2S>H2O.
| A. | ③⑤ | B. | ②③ | C. | ③④ | D. | ②④ |
15.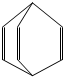 烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
 烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )| A. | 不慎将桶烯撒倒地面瓷砖上,可用火烤干 | |
| B. | 1mol桶烯在一定条件下能与3molCl2发生加成反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯可用做其它有机涂料的溶剂 |