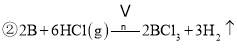题目内容
【题目】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如图1:
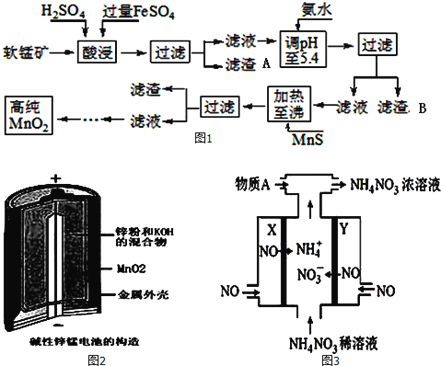
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
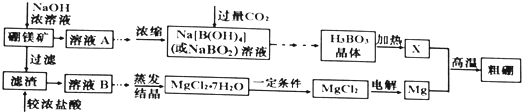
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________;
(2)滤渣A的主要成分是____________;滤渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+杂质,可能原因是_________________;
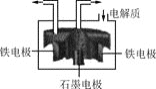
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为________________,电池总反应的方程式为_______________________;
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极__________极,电解时阳极的电极反应为________________,使电解产物全部转化为NH4NO3,需补充物质A,A是__________;
【答案】2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O SiO2 Fe(OH)3和Al(OH)3 CuS、ZnS的溶解度较MnS小 MnO2+H2O+e-═MnOOH+OH- Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 阴 NO-3e-+2H2O=NO3-+4H+ NH3
【解析】
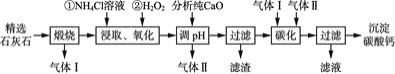
软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰。
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时二氧化硅不反应,滤渣A为SiO2,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣B的主要成分为Fe(OH)3和Al(OH)3;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+;
(4)在反应中Zn元素化合价升高,被氧化,Zn在负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2在正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,反应的化学方程式为:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2;
(5)X极发生的是NO得到电子生成NH4+的反应,所以X极为阴极,Y极发生的是NO失电子生成NO3-的反应,所以Y为阳极,电极反应为NO-3e-+2H2O=NO3-+4H+,X阴极反应为:NO+5e-+6H+=NH4++H2O;使得失电子总数相等,阳极反应为5NO-15e-+10H2O=5NO3-+2OH-,阴极反应为:3NO+15e-+18H+=3NH4++3H2O,相加得总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,和总反应生成硝酸生成硝酸铵。故答案为:NO-3e-+2H2O=NO3-+4H+NH3,NH3。
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,和总反应生成硝酸生成硝酸铵。故答案为:NO-3e-+2H2O=NO3-+4H+NH3,NH3。
【点晴】
流程分析是解题关键;软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰;据此解题可迎刃而解。