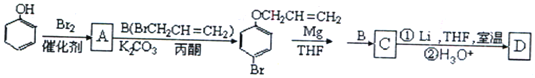
题目内容
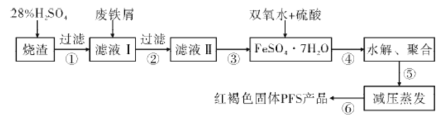
【题目】水是一种重要的自然资源,水质优劣直接影响人体健康,水处理技术在生产、生活中应用广泛。聚合硫酸铁(PFS)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)和废铁屑为原料制取聚合硫酸铁([Fe2(OH)x(SO4)3-![]() ]m)的工艺流程如图:
]m)的工艺流程如图:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______(填标号)。
a.容量瓶 b.烧杯 c.玻璃棒 d.分液漏斗
(2)废铁屑表面附有铁锈,铁锈的主要成分为______,步骤③的具体实验操作有____。
(3)水解、聚合要严控pH和温度。pH偏小时Fe3+水解程度弱,pH偏大时则______。写出水解、聚合反应生成PFS的化学方程式:_________。
(4)步骤⑥相对于常压蒸发,减压蒸发的优点是_________。
(5)污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质能作为沉淀剂的是_______(填标号)。
a.氨水 b.硫化氢气体 c.硫酸钠溶液 d.纯碱溶液
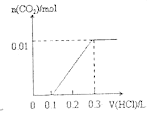
(6)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.5×10-3mol/L,c(Mg2+)=6.4×10-4mol/L,则此水的硬度为______。
【答案】bc Fe2O3·nH2O或Fe2O3 蒸发浓缩,冷却结晶、过滤(洗涤) 形成氢氧化铁沉淀 mFe2(SO4)3+xmH2O![]() [Fe2(OH)x(SO4)3-
[Fe2(OH)x(SO4)3-![]() ]m+
]m+![]() H2SO4 降低蒸发温度防止产物分解 bd 12°
H2SO4 降低蒸发温度防止产物分解 bd 12°
【解析】
黄铁矿的烧渣中主要成分为Fe2O3、FeO、SiO2,向其中加入稀硫酸,发生反应产生FeSO4、Fe2(SO4)3,SiO2不溶于水,将其过滤除去,向滤液I中加入废Fe屑,Fe2(SO4)3会发生反应产生FeSO4,过滤除去过量的铁屑,将滤液II蒸发浓缩、冷却结晶、过滤洗涤得到FeSO4·7H2O,向其中加入H2SO4、H2O2,发生氧化还原反应产生Fe2(SO4)3,然后经水解、聚合得到PFS。
(1)根据配制一定质量分数溶液的步骤确定使用的仪器;
(2)铁锈主要成分是氧化铁或氧化铁的结晶水合物;
(3)结合盐的水解规律及盐水解的酸碱性分析;
(4)根据温度与盐的稳定性及物质的沸点关系分析;
(5)除去杂质不能引入新的杂质,据此分析;
(6)根据硬度含义,把Ca2+、Mg2+的浓度转化为用物质质量表示的硬度。
(1)配制一定质量分数稀硫酸要在烧杯中进行,首先根据计算用量筒量取一定体积的浓硫酸,将其沿烧杯内部缓缓倒入盛有一定质量水的烧杯中,并用玻璃棒不断搅拌,再加入水直至前后使用的水量与计算一致时,停止加入,搅拌均匀,就得到待求质量分数的溶液。故使用的仪器,除量筒外,还需要烧杯和玻璃棒,故合理选项是bc;
(2)铁锈主要成分是氧化铁的结晶水合物或氧化铁,化学式写为Fe2O3·nH2O或Fe2O3;步骤③是从FeSO4溶液中获得的FeSO4·7H2O,具体实验操作有蒸发浓缩,冷却结晶、过滤(洗涤);
(3)铁盐是强酸弱碱盐,在溶液中Fe3+水解使溶液显酸性,增大溶液中c(H+),盐水解程度减小,即pH偏小时Fe3+水解程度弱,pH偏大时则水解程度增大,会形成氢氧化铁沉淀。根据题意可知Fe2(SO4)3水解、聚合反应生成PFS的化学方程式为:mFe2(SO4)3+xmH2O![]() [Fe2(OH)x(SO4)3-
[Fe2(OH)x(SO4)3-![]() ]m+
]m+![]() H2SO4。
H2SO4。
的水解规律及盐水解的酸碱性分析;
(4)降低压强,物质的沸点降低,降低蒸发温度能够防止产物分解,所以减压蒸发比常压蒸发好;
(5)a.氨水会使金属阳离子形成沉淀,但会引入新的杂质离子NH4+,不符合题意;
b.硫化氢气体会使杂质离子形成溶解度小的CuS、HgS、PbS沉淀,然后经过滤除去,b符合题意;
c.硫酸钠溶液不能除去Cu2+,去除效果不理想,c不符合题意;
d.纯碱溶液与杂质离子反应会形成金属氢氧化物沉淀除去,d符合题意;
故合理选项是bd;
(6)c(Ca2+)=1.5×10-3mol/L,则c(Mg2+)=6.4×10-4mol/L,1L水中含有n(Ca2+)=1.5×10-3mol,n(Mg2+)=6.4×10-4mol,根据元素守恒可得m(CaO)= 1.5×10-3mol×56g/mol×1000mg/g=84mg,m(MgO)=6.4×10-4mol×40g/mol×1000mg/g=25.6mg,所以该水的硬度为![]() =12°。
=12°。

 阅读快车系列答案
阅读快车系列答案