题目内容
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):

(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O![]() NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。
【答案】 MnO2+SO2===MnSO4或H2O+SO2 ===H2SO3、MnO2+H2SO3===MnSO4+H2O Fe(OH)3、Al(OH)3 Na2S会增大回收的(NH4)2SO4中Na+含量 4OH--4e-=== O2↑+2H2O Mn2++2HCO3- ![]() MnCO3↓+CO2↑+H2O 使MnSO4充分转化为MnCO3; NH4HCO3受热易分解,造成损失;NH4HCO3能与H+反应,防止MnCO3沉淀溶解损失 5.7×10-10
MnCO3↓+CO2↑+H2O 使MnSO4充分转化为MnCO3; NH4HCO3受热易分解,造成损失;NH4HCO3能与H+反应,防止MnCO3沉淀溶解损失 5.7×10-10
【解析】由流程可知,“脱硫浸锰”环节:二氧化硫与软锰矿浆作用生成硫酸锰和少量的硫酸铝、硫酸亚铁等,二氧化硅不反应经过滤成为滤渣Ⅰ;氧化环节:双氧水可将亚铁离子氧化为铁离子;加氨水调节溶液的pH=5~6把铁离子和铝离子转化为沉淀除去;加硫化铵把重金属转化为沉淀除去;通过电解得到金属锰;在阳极液中加碳酸氢铵得碳酸锰和硫酸铵等,据此分析解答。
(1)“脱硫浸锰”生成MnSO4的反应的化学方程式为 MnO2+SO2=MnSO4或H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O;(2)加入氨水沉淀金属阳离子,“滤渣2”中主要成分的化学式为Fe(OH)3、Al(OH)3;(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是 加Na2S会引入钠离子,增大回收的(NH4)2SO4中Na+含量;(4)“电解”时用惰性电极,阳极应该是水电离出的氢氧根离子放电,电极反应式为 2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O;(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为 Mn2++2HCO3- ![]() MnCO3↓+CO2↑+H2O;原溶液显酸性,且碳酸氢铵受热易分解,故“50℃碳化”时加入过量NH4HCO3,可能的原因是NH4HCO3与H+反应,防止MnCO3沉淀溶解损失,以及防止NH4HCO3受热分解损失;(6)根据方程式NH4++H2O
MnCO3↓+CO2↑+H2O;原溶液显酸性,且碳酸氢铵受热易分解,故“50℃碳化”时加入过量NH4HCO3,可能的原因是NH4HCO3与H+反应,防止MnCO3沉淀溶解损失,以及防止NH4HCO3受热分解损失;(6)根据方程式NH4++H2O![]() NH3·H2O+H+可知反应的平衡常数=
NH3·H2O+H+可知反应的平衡常数=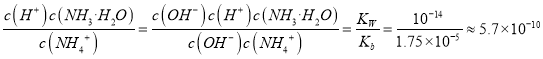 。
。

 特高级教师点拨系列答案
特高级教师点拨系列答案
