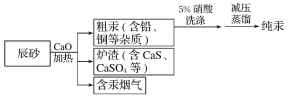
题目内容
【题目】室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
选项 | 加入的物质 | 结论 |
A | 50mL 1mol·L﹣1H2SO4 | 反应结束后,c(Na+)=c(SO42﹣) |
B | 0.05mol CaO | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH﹣)不变 |
D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
【答案】B
【解析】
A.n(H2SO4)=1mol/L×0.05L=0.05mol=n(Na2CO3),所以二者恰好完全反应生成Na2SO4,Na2SO4是强电解质,完全电离,则溶液中存在c(Na+)=2c(SO42-),故A错误;B.加入0.05molCaO,发生的一系列反应为CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,且氢氧化钙和碳酸钠前后完全反应,导致溶液中c(OH-)增大、c(CO32-)减小,则溶液中![]() 增大,故B正确;C.加入水后,溶液中c(Na2CO3)减小,pH减小,则溶液中c(H+)减小,水电离出的c(H+)=c(OH-),所以该溶液中水电离出的c(H+)c(OH-)减小,故C错误; D.Na2CO3水解导致溶液呈碱性,NaHSO4和Na2CO3反应方程式为:2NaHSO4+Na2CO3=Na2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成Na2SO4、H2O、CO2,溶液中的溶质是Na2SO4,溶液呈中性,溶液的pH减小,加入的硫酸氢钠中含有钠离子,所以c(Na+)增大,故D错误;故选B。
增大,故B正确;C.加入水后,溶液中c(Na2CO3)减小,pH减小,则溶液中c(H+)减小,水电离出的c(H+)=c(OH-),所以该溶液中水电离出的c(H+)c(OH-)减小,故C错误; D.Na2CO3水解导致溶液呈碱性,NaHSO4和Na2CO3反应方程式为:2NaHSO4+Na2CO3=Na2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成Na2SO4、H2O、CO2,溶液中的溶质是Na2SO4,溶液呈中性,溶液的pH减小,加入的硫酸氢钠中含有钠离子,所以c(Na+)增大,故D错误;故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目