题目内容
【题目】铝土矿是冶炼金属铝的重要原料,其中主要成分为 Al2O3、Fe2O3 等。工业上可 NaOH 溶解 Al2O3 使 其与杂质分离:Al2O3+2NaOH═2NaAlO2+H2O
(1)找出上述反应中化合价为负值的元素,写出其原子的电子式_____。
(2)同温同压下,上述元素形成的气体密度最大的物质的分子式为_____。
(3)上述反应中两种金属元素对应单质的活泼性强弱关系为:____,从原子结构的角度分 析其原因:_________。
(4)若根据化学性质进行物质分类,则 Al2O3 属于______氧化物,据此推测下列反应方程式正确的是______。
A.Al2O3+3H2O═2Al(OH)3
B.2Al(OH)3+3H2SO4═Al2(SO4)3+3H2O
C.Al(OH)3+NaOH═NaA1O2+2H2O
D NaAlO2+4HCl═AlCl3+2H2O
【答案】![]() O3 Na>Al 两者电子层数相同,Na的质子数比Al的质子数小,较易失去最外层电子 两性 BCD
O3 Na>Al 两者电子层数相同,Na的质子数比Al的质子数小,较易失去最外层电子 两性 BCD
【解析】
(1)Al2O3+2NaOH=2NaAlO2+H2O中Na、H为+1价,Al为+3价,O为﹣2价,O的最外层有6个电子;
(2)同温同压下,上述元素形成的气体密度最大的物质为臭氧;
(3)同周期从左往右金属性减弱;
(4)Al2O3可与酸、强碱反应生成盐和水,为两性氧化物。
(1)只有O为负价,氧原子的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)同温同压下,上述元素形成的气体密度最大的物质的分子式为O3,故答案为:O3;
(3)上述反应中两种金属元素对应单质的活泼性强弱关系为Na>Al;从原子结构的角度分析其原因为两者电子层数相同,Na的质子数比Al的质子数小,较易失去最外层电子,故答案为:Na>Al;两者电子层数相同,Na的质子数比Al的质子数小,较易失去最外层电子;
(4)Al2O3可与酸、强碱反应生成盐和水,为两性氧化物;氧化铝与水不反应,氢氧化铝为两性氢氧化物,则BC中方程式合理,氢氧化铝可溶于盐酸,则D中合理,故答案为:两性;BCD。

【题目】以硅石(主要成分SiO2)为起始原料生产高纯多晶硅的简化工艺流程如下图所示:
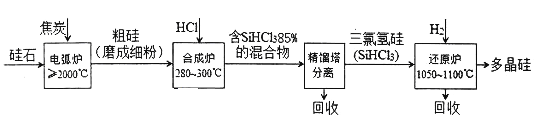
(1)在电弧炉中,生成粗硅的化学方程式为____________,该反应氧化剂与还原剂物质的量之比为_____________。
(2)合成炉中有关反应的数据如下表所示:
热化学方程式 | 平衡常数 | |
主反应 | Si(s)+3HCl(g) | K1 |
副反应 | Si(s)+4HCl(g) | K2 |
①主反应的温度需严格控制在280~300℃之间,若温度过低,则__________________;若温度太高,SiHCl3则会转化生成SiCl4,该转化的热化学方程式为_____________________。
②平衡时,![]() 的值a随着
的值a随着![]() 的值b的变化而变化,则
的值b的变化而变化,则![]() =______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高
=______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高![]() 的值,请用平衡移动原理加以解释________________________。
的值,请用平衡移动原理加以解释________________________。
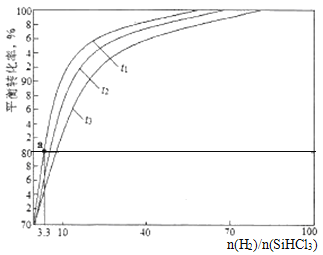
(3)还原炉中的主要反应为SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H>0。实验室中在1.0L密闭容器中研究得到SiHCl3的转化率在不同温度条件下随n(H2)/(SiHCl3)变化的曲线如图所示。t1、t2、t3表示的温度高低顺序为_______;t1温度时平衡常数Ka=______(保留两位小数)。
【题目】室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
选项 | 加入的物质 | 结论 |
A | 50mL 1mol·L﹣1H2SO4 | 反应结束后,c(Na+)=c(SO42﹣) |
B | 0.05mol CaO | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH﹣)不变 |
D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D