题目内容
【题目】锌-空气电池(原理如图)适宜用作城市电动车的动力电源,放电时Zn转化为ZnO。则该电池放电时下列说法正确的是()

A.将电能转化为化学能
B.氧气在石墨电极上发生氧化反应
C.电子由Zn电极经导线流向石墨电极
D.该电池放电时OH-向石墨电极移动
【答案】C
【解析】
该装置为原电池,根据原电池的工作原理进行解答;
A、该装置为原电池,将化学能转化成电能,故A错误;
B、根据装置图,Zn为负极,石墨电极为正极,根据原电池的工作原理,氧气在正极上发生还原反应,故B错误;
C、根据原电池的工作原理,电子从负极经外电路流向正极,即电子从Zn极经导线流向石墨电极,故C正确;
D、根据原电池的工作原理,阴离子向负极移动,即移向Zn极,故D错误;
答案选C。

【题目】室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
选项 | 加入的物质 | 结论 |
A | 50mL 1mol·L﹣1H2SO4 | 反应结束后,c(Na+)=c(SO42﹣) |
B | 0.05mol CaO | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH﹣)不变 |
D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
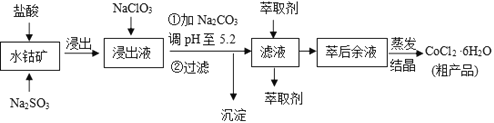
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式______________________________。
(2)写出NaClO3发生反应的主要离子方程式________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________________________________________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________、_______________________
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________________。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______。(答一条即可)
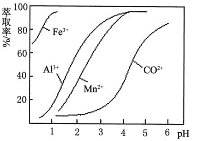
(6)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________;其使用的适宜pH范围是__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
