题目内容
【题目】Ⅰ 硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。
①羰基硫的电子式为__________。
②下列能说明碳与硫两元素非金属性相对强弱的是_______(填字母代号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
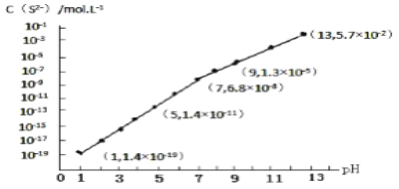
①pH=13时,溶液中的c(H2S)+c(HS-)=______ mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=_______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
Ⅱ.降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是__________。
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:
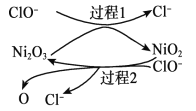
ii.过程 1 的离子方程式是__________。
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是__________。
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。
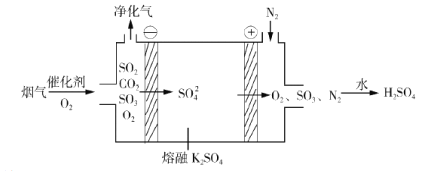
i.在阴极放电的物质是______。
ii.在阳极生成 SO3的电极反应式是______。
【答案】![]() ac 5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O 0.043 5 ClO-+SO2+2OH- ===Cl-+SO42-+H2O Ni2O3+ClO- ===2NiO2 +Cl- Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行 O2 SO2 - 2e- +SO42-= 2SO3
ac 5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O 0.043 5 ClO-+SO2+2OH- ===Cl-+SO42-+H2O Ni2O3+ClO- ===2NiO2 +Cl- Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行 O2 SO2 - 2e- +SO42-= 2SO3
【解析】
Ⅰ(1)①羰基硫分子中所有原子均满足8电子结构,可看作是二氧化碳分子中的一个氧原子被硫原子代替,由此和CO2对比书写羰基硫分子的电子式;
②相同条件下,钠盐的PH对应酸的酸性越弱;最高价氧化物水化物的酸性也强,非金属性越强,不是最高价则无法比较;非金属单质和氢气化合越容易、氢化物越稳定,非金属性越强。
(2)根据题给信息,书写化学方程式;
(3)①依据物料守恒分析;②依据![]() 计算Mn2+开始沉淀时的
计算Mn2+开始沉淀时的![]() 。
。
Ⅱ. ①NaClO 碱性溶液吸收法,工业上可用 NaClO 碱性溶液吸收 SO2。
i.利用NaClO的氧化性,将SO2在溶液中氧化成H2SO4;
ii. 由图可以看出过程 1 的反应是,ClO-和Ni2O3反应生成Cl-和NiO2;
iii Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,是因为 Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行。
②由电化学脱硫装置可知,该装置为电解池,依据电极反应分析解答相关问题。
Ⅰ(1)①由羰基硫分子中所有原子均满足8电子结构,可看作是二氧化碳分子中的一个氧原子被硫原子代替,则羰基硫分子的电子式应为![]() 。
。
本题答案为:![]() 。
。
②a项,相同条件下水溶液的![]() :
:![]() ,说明碳酸的酸性弱于硫酸,碳酸和硫酸为C和S的最高价氧化物对应的水化物,则证明非金属性S
,说明碳酸的酸性弱于硫酸,碳酸和硫酸为C和S的最高价氧化物对应的水化物,则证明非金属性S![]() C,故选a项;
C,故选a项;
b项,由于HSO3不是S的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故不选b项;
c项,S与H2的化合比C与H2的化合更容易,说明S形成的氢化物比C的氢化物更稳定,即![]() 非金属性更强,故选c项;
非金属性更强,故选c项;
本题答案为ac。
(2)H2S与KMnO4在酸性条件下反应的化学方程式为:![]() 。
。
本题答案为:5H2S![]() 2KMnO4
2KMnO4![]() 3H2SO4=3S
3H2SO4=3S![]() 2MnSO4
2MnSO4![]() K2SO4
K2SO4![]() 8H2O。
8H2O。
(3)①溶液中存在![]() ,当
,当![]() 时,
时,![]() ,则
,则![]() ;
;
本题答案为:0.043nol/L。
②根据![]() 可知,
可知,![]() 开始沉淀时,
开始沉淀时,![]() ,此时对应溶液的
,此时对应溶液的![]() 值为5。
值为5。
本题答案为:5.
Ⅱ①NaClO 碱性溶液吸收法,工业上可用 NaClO 碱性溶液吸收 SO2。
i.利用NaClO的氧化性,将SO2在溶液中氧化成H2SO4,离子方程式为:ClO-+SO2+2OH- ===Cl-+SO42-+H2O;
本题答案为:ClO-+SO2+2OH- ===Cl-+SO42-+H2O。
ii.由图可以看出过程 1 的反应是,ClO-和Ni2O3反应生成Cl-和NiO2,离子方程式为:Ni2O3+ClO- ===2NiO2 +Cl-;
本题答案为:Ni2O3+ClO- ===2NiO2 +Cl-。
iii Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO 更好,是因为 Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行;
本题答案为:Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行。
②由电化学脱硫装置可知,该装置为电解池,烟气经催化氧化后,部分二氧化硫,被氧化成三氧化硫,所得气体通过该装置,在阴极O2得到电子被还原,电极反应式为:O2![]() 4e-
4e-![]() 2SO3=2SO42-;在阳极,SO2失去电子,被氧化成SO3,电极反应式为:SO2-2e-
2SO3=2SO42-;在阳极,SO2失去电子,被氧化成SO3,电极反应式为:SO2-2e-![]() SO42-=2SO3;
SO42-=2SO3;
则i.在阴极放电的物质是:O2。
ii.在阳极生成 SO3的电极反应式是:SO2-2e-![]() SO42-=2SO3。
SO42-=2SO3。
本题答案为:O2,SO2-2e-![]() SO42-=2SO3。
SO42-=2SO3。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案