题目内容
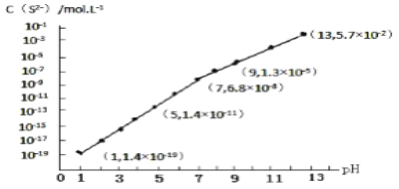
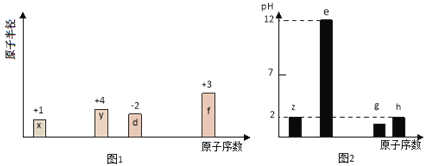
【题目】有八种短周期主族元素x、y、z、d、e、f、 g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01 mol/L)的pH与原子序数的关系如图2所示。
根据上述信息进行判断,并回答下列问题:
(1)g在元素周期表中的位置是____________________。
(2)比较d、e、f的简单离子半径大小为______<______<______(用离子符号表示);y、h 的最高价氧化物对应水化物酸性较强的是__________(用化学式表示)。
(3)下列可作为比较e和f金属性强弱的依据是________。
A.测等浓度相应氯化物水溶液的pH
B.测两种元素单质的硬度和熔、沸点
C.比较单质做还原剂时失去的电子数目的多少
D.比较两种元素在化合物中化合价的高低
E.比较单质与同浓度盐酸反应的剧烈程度
(4)据报道,最近意大利科学家获得了极具研究价值的z4,其分子结构与白磷分子(P4)的正四面体结构相似。已知断裂1 mol z-z键吸收167 kJ热量,生成1 mol Z≡Z键放出942 kJ热量,请写出z4气体在一定条件下生成z2气体反应的热化学方程式___________________。
(5)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄露时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为___________________________________________。已知eyz含有z2分子中类似的化学键,写出化合物eyz的电子式____________。
【答案】 第三周期第ⅥA族 Al3+ Na+ O2- HClO4 AE N4(g)=2N2(g)△H=-882kJ/mol NaCN+H2O2+H2O=NaHCO3+NH3↑ ![]()
【解析】试题从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,d是O元素,f是Al元素,z、e、g、h的最高价氧化物对应水化物溶液浓度均为0.01molL﹣1,e的pH为12,为一元强碱,则e是Na元素,z、h的pH均为2,为一元强酸,则z为N元素、h为Cl元素;g的pH小于2,则g的为二元强酸,故g为S元素。
解析:(1)g为S元素,处于周期表中第三周期第ⅥA族 。
(2)电子层结构相同的离子,核电荷数越大离子半径越小,则离子半径:Al3+< Na+ < O2-;非金属性越强最高价氧化物水化物的酸性越强,非金属性Cl>S,所以HClO4的酸性强。
(3)A.溶液pH越小,金属阳离子水解程度越大,则对应元素的金属性越弱,故A正确;B.单质的硬度和熔、沸点,属于物理性质,不能比较金属强弱,故B错误;C.金属性强弱与失去电子数目无关,与得失电子难易有关,故C错误;D、元素在化合物中化合价的高低与得失电子数有关,与得失电子难易无关,故D错误; E.单质与同浓度盐酸反应越剧烈,说明金属性越强,故E正确;故选:AE;
(4)根据原子守恒知,一个N4分子生成2个N2分子,一个N4分子中含有6个N﹣N键,破坏1molN4分子中含有6molN﹣N键需要吸收167kJ/mol×6mol=1002kJ能量;生成2molN≡N键放出942kJ/mol×2mol=1884kJ能量,所以该反应放出1884kJ﹣1002kJ=882kJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=﹣882kJ/mol;
(5)化合物NaCN不慎泄露时,通常采用喷洒过氧化氢溶液的方式处理,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,所以生成NaHCO3、NH3,反应方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;NaCN由Na+、CN﹣构成,含有N2分子中类似的化学键,则CN﹣中存在三键,NaCN电子式为![]() 。
。

【题目】实验室用下图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略)。

(1)a仪器的名称是:______。
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是_______;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:___________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入(填符号)___________。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯____溴(填“大于”或“小于”)。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡后静置。观察到的现象是_____________________。
(6)F处为尾气吸收装置, 写出实验室利用烧碱溶液吸收Cl2的离子方程式__________________________。
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |