题目内容
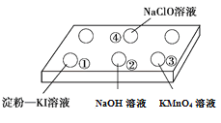
【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝且无其他明显现象 |
②中无明显现象 | |
③中溶液褪色 | |
④中产生黄绿色气体 |
下列分析正确的是( )
A.①中现象体现了浓盐酸的氧化性
B.②中现象说明未发生反应
C.③中反应后氯元素全部以KCl形式存在
D.④中产生黄绿色气体的反应是:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O
【答案】D
【解析】
A. 盐酸滴入KI淀粉溶液中不反应,故无现象,故A错误;
B. ②中无现象说明盐酸和氢氧化钠反应生成氯化钠和水的过程没有明显的现象,并不是不反应,故B错误;
C. 盐酸与高锰酸钾反应的化学方程式为2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,③中反应后氯元素全部以KCl和MnCl2形式存在,故C错误;
D. 次氯酸钠与盐酸发生氧化还原反应,产生氯气,④中产生黄绿色气体的反应是:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O,故D正确;
答案选D。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向X溶液中滴加 | X溶液中一定含有 |
B | 向浓度均为0.05mol·L-1的 |
|
C | 向2mL浓度均为0.05mol·L-1的 |
|
D | 向 | 结合 |
A.AB.BC.CD.D
【题目】![]() 反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:
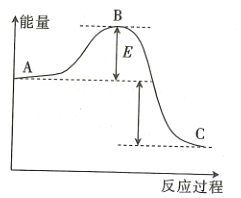
(1)该反应是______________(填“放热”或“吸热”)反应。
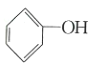
(2)用![]() 作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
(3)在体积为2L的恒容密闭容器中通入2mol![]() 和3mol
和3mol![]() 发生上述反应,10min内
发生上述反应,10min内![]() 的物质的量变化如下表:
的物质的量变化如下表:
反应时间(min) | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
①升高温度,反应速率______________(填“增大”或“减小”)。
②上述反应在7min时_______________(填“达到”或“未达到”)平衡状态。
③![]() min内,用
min内,用![]() 表示该反应的反应速率为_______________mol·L-1·min-1。
表示该反应的反应速率为_______________mol·L-1·min-1。