题目内容
10.相同状况下,等质量的O2和CO2相比较,下列叙述正确的是( )| A. | 体积比为8:11 | B. | 分子个数之比为1:1 | ||
| C. | 物质的量之比为11:8 | D. | 原子个数之比为12:11 |
分析 令O2和CO2的质量为1g,根据n=$\frac{m}{M}$计算各自物质的量,由V=nVm可知,同温同压下气体体积之比等于物质的量之比,由N=nNA可知,分子数目之比等于物质的量之比,结合分子含有原子数目计算原子总物质的量,进而计算而所含原子数目之比.
解答 解:令O2和CO2的质量为1g,则O2物质的量为$\frac{1}{32}$mol、CO2的物质的量=$\frac{1g}{44g/mol}$=$\frac{1}{44}$mol,
A.由V=nVm可知,同温同压下气体体积之比等于物质的量之比,故等质量O2和CO2的体积之比=$\frac{1}{32}$mol:$\frac{1}{44}$mol=11:8,故A错误;
B.由N=nNA可知,分子数目之比等于物质的量之比,故等质量O2和CO2的分子数之比=$\frac{1}{32}$mol:$\frac{1}{44}$mol=11:8,故B错误;
C.故等质量O2和CO2的物质的量之比=$\frac{1}{32}$mol:$\frac{1}{44}$mol=11:8,故C正确;
D.故等质量O2和CO2含有原子数之比=$\frac{1}{32}$mol×2:$\frac{1}{44}$mol×3=11:12,故D错误,
故选C.
点评 本题考查物质的量有关计算,难度不大,注意对公式的理解与灵活运用,侧重对基础知识的巩固.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
1.下列反应的离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氧化铝溶于氢氧化钠:Al2O3+2OH-═2AlO2-+H2↑ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
18.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 11.2L甲烷含有的氢原子数为2NA | |
| B. | 1mol氧气在化学反应中得到的电子数一定为4NA | |
| C. | 28g丙烯中含有的碳氢键的数目为4NA | |
| D. | 1mol/L的硝酸中含有的硝酸根离子的数目为4NA |
5.下列各组微粒中,属于同素异形体的是( )
| A. | O2、O3 | B. | H、D、T | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | Na2O、Na2O2 |
2.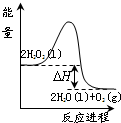 过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
 过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )| A. | 该分解反应为吸热反应 | |
| B. | 2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量 | |
| C. | 加入MnO2或FeCl3均可提高该分解反应的速率 | |
| D. | 其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢 |
6.分子式为C5H10O2的羧酸共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 种 |
 与葡萄糖
与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物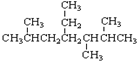 的名称为2,5,6-三甲基-4-乙基庚烷.
的名称为2,5,6-三甲基-4-乙基庚烷.