题目内容
5.下列各组微粒中,属于同素异形体的是( )| A. | O2、O3 | B. | H、D、T | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | Na2O、Na2O2 |
分析 化学上把同种元素组成的不同种单质互称为这种元素的同素异形体,属于同素异形体的物质必须满足:同种元素、不同单质,据此进行判断.
解答 解:A.O2、O3为氧元素的不同单质,二者互为同素异形体,故A正确;
B.H、D、T都是氢原子,具有相同质子数、不同中子数,互为同位素,故B错误;
C.二者表示不同的元素的原子,不属于同素异形体,故C错误;
D.过氧化钠和氧化钠都是钠的氧化物,不属于同素异形体,故D错误;
故选A.
点评 本题考查了同素异形体的判断,试题侧重基础知识的考查,题目难度不大,明确同素异形体研究对象为单质即可解答,注意掌握同素异形体与同位素的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.如图为反应2A(g)?B(g)+C(g)的速率v(A)变化的图象,其中纵坐标可能是( )


| A. | 温度 | B. | 压强 | C. | A的浓度 | D. | 反应时间 |
16.下面是用电子式表示某些物质的形成过程,其中正确的是( )
| A. | H•+ →H+[ →H+[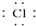 ]- ]- | B. | K•+ →K →K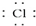 | C. | 2H•+ →H →H H H | D. | 2Na•+ →Na →Na Na Na |
20.1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C$\frac{\underline{\;煅烧\;}}{\;}$Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3$\frac{\underline{\;煅烧\;}}{\;}$Na2CO3+CaS
下列说法正确的是( )
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C$\frac{\underline{\;煅烧\;}}{\;}$Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3$\frac{\underline{\;煅烧\;}}{\;}$Na2CO3+CaS
下列说法正确的是( )
| A. | 第②步中氧化剂与还原剂的物质的量之比为1:4 | |
| B. | 反应①体现了硫酸的强酸性 | |
| C. | 该方法对环境污染较小 | |
| D. | 该方法对生产设备基本没有腐蚀 |
10.相同状况下,等质量的O2和CO2相比较,下列叙述正确的是( )
| A. | 体积比为8:11 | B. | 分子个数之比为1:1 | ||
| C. | 物质的量之比为11:8 | D. | 原子个数之比为12:11 |
17.白藜芦醇的结构简式为: ,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
 ,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )| A. | 1mol,1mol | B. | 3.5mol,7mol | C. | 3.5mol,6mol | D. | 6mol,7mol |
1.在常温下,把一个盛有等物质的量的甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体充分反应,下列叙述中不正确的是( )
| A. | 容器内原子总数不变 | |
| B. | 足够长时间后容器内氯化氢分子数最少 | |
| C. | 容器内气体颜色变浅 | |
| D. | 容器内分子总数不变 |
2.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- | |
| B. | 加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3- | |
| C. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO32- |
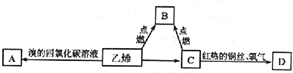
 ,乙烯燃烧时的现象是火焰明亮,伴有黑烟,放热;
,乙烯燃烧时的现象是火焰明亮,伴有黑烟,放热;