题目内容
1.下列反应的离子方程式正确的是( )| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氧化铝溶于氢氧化钠:Al2O3+2OH-═2AlO2-+H2↑ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
分析 A.电荷不守恒、转移电子不守恒;
B.氧化铝溶于氢氧化钠溶液生成偏铝酸钠和水;
C.一水合氨是弱电解质,要写化学式,且氢氧化铝难溶于弱碱;
D.二氧化碳过量时生成碳酸氢钙.
解答 解:A.电荷不守恒、转移电子不守恒,离子方程式为2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.氧化铝溶于氢氧化钠溶液生成偏铝酸钠和水,离子方程式为Al2O3+2OH-═2AlO2-+H2O,故B错误;
C.一水合氨是弱电解质,要写化学式,且氢氧化铝难溶于弱碱,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C正确;
D.二氧化碳过量时生成碳酸氢钙,离子方程式为OH-+CO2═HCO3-,故D错误;
故选C.
点评 本题考查离子方程式的书写,为高频考点,明确离子方程式书写规则及物质的性质即可解答,注意某些反应还与物质的量的量有关,易错选项是C,注意离子方程式书写要遵循客观事实、原子守恒及转移电子守恒和电荷守恒.

练习册系列答案
相关题目
11. 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | E1-E2=△H | |
| B. | 该反应为吸热反应 | |
| C. | 升高温度,不影响活化分子百分数 | |
| D. | 使用催化剂使该反应的反应热发生改变 |
12.下列离子方程式书写正确的是( )
| A. | 向FeBr2溶液中通入少量Cl2:2Br-+Cl2═2Cl-+Br2 | |
| B. | 澄清石灰水与少量的小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- |
9.下列有关因果关系的描述正确的是( )
| A. | 因为盐酸的酸性强于氢硫酸,所以氯元素的非金属性强于硫 | |
| B. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl?K↑+NaCl) | |
| C. | 因为某吸热反应能自发进行,所以该反应是熵减反应 | |
| D. | 因为醋酸电离吸热,所以用NaOH溶液恰好中和等体积等浓度的醋酸和盐酸,前者放出热量少 |
16.下面是用电子式表示某些物质的形成过程,其中正确的是( )
| A. | H•+ →H+[ →H+[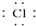 ]- ]- | B. | K•+ →K →K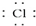 | C. | 2H•+ →H →H H H | D. | 2Na•+ →Na →Na Na Na |
10.相同状况下,等质量的O2和CO2相比较,下列叙述正确的是( )
| A. | 体积比为8:11 | B. | 分子个数之比为1:1 | ||
| C. | 物质的量之比为11:8 | D. | 原子个数之比为12:11 |
18.有机物中碳原子和氢原子个数比为3:4,不能与溴水反应却能使KMnO4酸性溶液褪色.其蒸气密度是相同状况下甲烷密度的7.5倍.在溴化铁存在时与溴反应,能生成两种一溴代物.该有机物可能是( )
| A. | CH≡C-CH3 | B. | 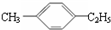 | C. | CH2=CHCH3 | D. | 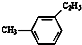 |
 已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
 ,乙烯燃烧时的现象是火焰明亮,伴有黑烟,放热;
,乙烯燃烧时的现象是火焰明亮,伴有黑烟,放热;