��Ŀ����
����Ŀ����������NOx����ҪָNO��NO2�����γ����ꡢ�⻯ѧ�������ƻ������㣬�Ǵ�����Ҫ��Ⱦ��֮һ����Чȥ�������е�NOx�ǻ�����������Ҫ���⡣
(1)�о����������������ڴ����к������ӵ������ʱ���漰���·�Ӧ:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)��K1����H1<0��(��)
NaNO3(s)+ClNO(g)��K1����H1<0��(��)
2NO(g)+Cl2(g)![]() 2ClNO(g)��K2����H2<0��(��)
2ClNO(g)��K2����H2<0��(��)
��4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)��ƽ�ⳣ��K=____(��K1��K2��ʾ)��
2NaNO3(s)+2NO(g)+Cl2(g)��ƽ�ⳣ��K=____(��K1��K2��ʾ)��
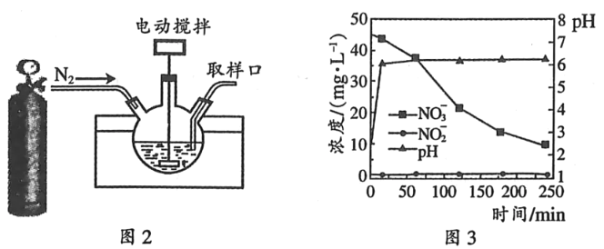
��Ϊ�о���ͬ�����Է�Ӧ(��)��Ӱ�죬�ں��������£���2 L�����ܱ������м���0.2 mol NO��0.1 mol Cl2��10 minʱ��Ӧ(��)�ﵽƽ�⡣���10 min����(ClNO)=7.5��10-3mol��L-1��min-1����ƽ���NO��ת������1=____�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½��У�ƽ��ʱNO��ת������2____��1(����>����<������=��)��ƽ�ⳣ��K2____(��������������С������������)��
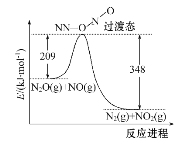
(2)NO����N2O��Ӧ����N2��NO2����Ӧ�������仯����ͼ��ʾ��������1 mol N2���䦤H=____kJ��mol-1��
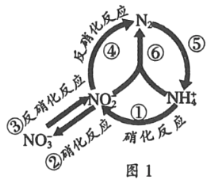
(3)NH3����ԭ��������(SCR)������ĿǰӦ����㷺���������������ѳ���������Ӧԭ����ͼ����ʾ��
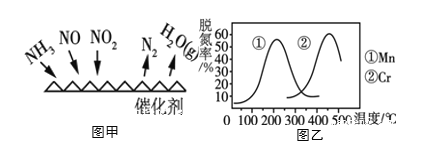
����ͼ��֪��SCR�����е�������Ϊ_____________����NO2��NO�����ʵ���֮��Ϊ1:1ʱ��������������һ�������·����ѵ���Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��ͼ���Dz�ͬ����Mn��Cr�ڲ�ͬ�¶��¶�Ӧ���ѵ��ʣ���ͼ��֪��ҵѡȡ����Ѵ���Ϊ________��
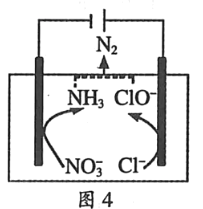
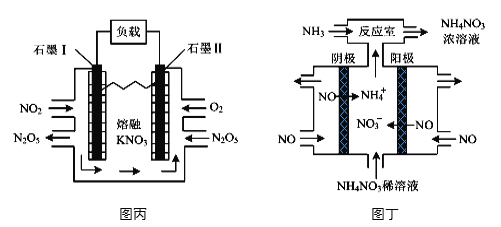
(4)���õ绯ѧװ�ÿ���������������Ⱦ�����Ϊ����ͼ��װ��ʵ�ֵ�����ת����ʽ��_______��ͼ��Ϊ���NO�Ʊ�NH4NO3��װ�ã���װ���������ĵ缫��ӦʽΪ___________________��
���𰸡�K12/K2 75% > ���� -139 NO2��NO 2NH3��NO2��NO![]() 2N2��3H2O Mn ��ѧ��ת��Ϊ���� NO��3e����2H2O=NO3����4H+
2N2��3H2O Mn ��ѧ��ת��Ϊ���� NO��3e����2H2O=NO3����4H+
��������
(1)����֪��(��)2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)��K1 ��H1��0��(��)2NO(g)+Cl2(g)2ClNO(g)��K2 ��H2��0�����ݸ�˹���ɢ���2-��ɵã�
�ڸ������ĵ�c(NO)=���ɵ�c(ClNO)�������ĵ�c(NO)�����ת����=![]() ��100%�ɵã����ں�ѹ�����½��У����ݷ�Ӧ���ص㣬����ں����൱������ѹǿ��
��100%�ɵã����ں�ѹ�����½��У����ݷ�Ӧ���ص㣬����ں����൱������ѹǿ��
(2)����ͼ1molN2O(g)��1molNO(g)������̬����209kJ�������ù���̬����1molN2(g)��1molNO2(g)�ų�����348kJ��д���Ȼ�ѧ����ʽ�ɵã�
(3)�ٸ����������õ�����Ԫ�ػ��ϼ۽��ͷ����ɵã���ϵ�ʧ�����غ���д����ʽ��
��ѡ�������Ҫ���¶ȵͣ������õģ�
(4)ͼ��Ϊԭ���װ�ã�ͼ��Ϊ���NO�Ʊ�NH4NO3��װ�ã�����ʧȥ���ӷ���������Ӧ��Ԫ�ػ��ϼ����ߣ�������Ի�����д�ɵá�
(1)����֪��(��)2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)��K1 ��H1��0��(��)2NO(g)+Cl2(g)2ClNO(g)��K2 ��H2��0�����ݸ�˹���ɢ���2-��ɵ�4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)������ƽ�ⳣ��K=![]() ��
��
�ڲ��10 min����(ClNO)=7.5��10-3molL-1min-1����10min�����ɵ�c(ClNO)=7.5��10-2molL-1�����ĵ�c(NO)=7.5��10-2molL-1����ƽ���NO��ת������1=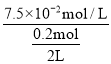 ��100%=75%�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½��У��÷�Ӧ������ӦΪ���������С�ķ�Ӧ�����ѹ����������ں���ѹǿ��ƽ�������ƶ������ѹ������NO��ƽ��ת���ʽϺ��ݴ���2����1����ѧƽ�ⳣ�����¶���أ��¶Ȳ��䣬K���䣬��K2���䣻
��100%=75%�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½��У��÷�Ӧ������ӦΪ���������С�ķ�Ӧ�����ѹ����������ں���ѹǿ��ƽ�������ƶ������ѹ������NO��ƽ��ת���ʽϺ��ݴ���2����1����ѧƽ�ⳣ�����¶���أ��¶Ȳ��䣬K���䣬��K2���䣻
(2)�������֪��1molN2O(g)��1molNO(g)������̬����209kJ�������ù���̬����1molN2(g)��1molNO2(g)�ų�����348kJ���ɵ��Ȼ�ѧ����ʽ��N2O(g)+NO(g)=N2(g)+NO2(g)��H=-139kJmol-1��
(3)����ͼ����֪��SCR������NH3��NO��NO2��Ӧ����ΪN2��ˮ��NO��NO2��NԪ�ػ��ϼ۽��ͣ���������ΪNO��NO2���ѵ�Ч�����ʱn(NO2)��n(NO)=1��1����Ӧ�Ļ�ѧ����ʽΪ��2NH3+NO2+NO![]() 2N2+3H2O��
2N2+3H2O��
�ڸ���ͼ��֪Mn����ʱ��200�������ѵ�����ߣ�Cr��������500�������ѵ�����ߣ������ߵ�����ѵ��ʲ�࣬ʹ��Mn��������Ҫ���¶ȵͣ������ã����ʹ�õ���ѵĴ���ΪMn��
(4)ͼ��Ϊԭ���װ�ã�����ת����ʽΪ����ѧ��ת��Ϊ���ܣ�ͼ��Ϊ���NO�Ʊ�NH4NO3��װ�ã�����ʧȥ���ӷ���������Ӧ��Ԫ�ػ��ϼ����ߣ���ΪNO�ŵ�����NO3-���缫��ӦΪ��NO-3e-+2H2O=NO3-+4H+��

 ��У����ϵ�д�
��У����ϵ�д�