题目内容
【题目】在一定温度下,醋酸溶液中存在电离平衡CH3COOH![]() CH3COO-+H+
CH3COO-+H+
(1)某温度时,0.1mol·L-1的醋酸溶液中的c(H+)与0.01mol·L-1的醋酸溶液中的c(H+)的比值___(填“大于”“小于”或“等于”)10;
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是:___;
A.c(H+) B.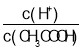 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
(3)现有pH均为3的醋酸、硫酸两瓶溶液:
①设两种溶液的物质的量浓度依次为c1、c2,则其关系式为:c1___c2(用“<”“>”或“=”表示,下同);
②取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入少量等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式为v1___v2;反应结束放出的氢气的体积依次为V1、V2,则其关系式为V1___V2。
【答案】小于 A > > =
【解析】
稀溶液稀释过程中,促进弱电解质电离平衡向电离方向移动,但电离常数不变。区分溶液浓度、溶液中氢离子浓度与溶液pH的关系,进而判断化学反应的速率。
(1)某温度时,将0.1 mol·L-1醋酸溶液稀释10倍得0.01 mol·L-1 醋酸溶液。若稀释过程中电离平衡(CH3COOH![]() CH3COO-+H+)不移动,则稀释前后c(H+)之比等于10。事实上,稀释电离平衡右移,故稀释前后c(H+)之比小于10,故答案为:小于;
CH3COO-+H+)不移动,则稀释前后c(H+)之比等于10。事实上,稀释电离平衡右移,故稀释前后c(H+)之比小于10,故答案为:小于;
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,电离平衡(CH3COOH![]() CH3COO-+H-)右移,溶液中n(H+)增大、c(H+)减小,c(CH3COO-)也减小,但KW=
CH3COO-+H-)右移,溶液中n(H+)增大、c(H+)减小,c(CH3COO-)也减小,但KW=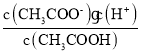 不变,则
不变,则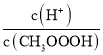 增大,c(H+)·c(OH-)=Kw不变,c(H+)减小,则c(OH-)增大,c(OH-)/c(H+)增大,故答案为:A;
增大,c(H+)·c(OH-)=Kw不变,c(H+)减小,则c(OH-)增大,c(OH-)/c(H+)增大,故答案为:A;
(3)①pH均为3的醋酸、硫酸两瓶溶液中,c(H+)都等于0.001 mol/L。因CH3COOH![]() CH3COO-+H+,醋酸溶液浓度c1>0.001 mol/L;又H2SO4=2H++SO42-,硫酸溶液浓度c2=0.0005 mol/L,则c1>c2,故答案为:>;
CH3COO-+H+,醋酸溶液浓度c1>0.001 mol/L;又H2SO4=2H++SO42-,硫酸溶液浓度c2=0.0005 mol/L,则c1>c2,故答案为:>;
②相同体积的两种酸分别加入等体积的蒸馏水后,因CH3COOH电离平衡右移,醋酸中c(H+)比硫酸中大,与锌反应较快,即v1>v2。因锌粉少量且等量,反应结束放出的氢气在同温同压时体积相等,即V1=V2,故答案为:>;=。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___;
(2)该反应为___(填“吸热”或“放热”)反应;
(3)能判断该反应达到化学平衡状态的依据是___;
A.容器中压强不变
B.混合气体中c(CO)不变
C.V正(H2)=V逆(H2O)
D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,则下一时刻,反应向___(填“正向”或“逆向”)进行。
【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 ______ ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 ______ .
(2)操作Ⅱ中红色褪去的可能原因是 ______ .
(3)用反应![]() 测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______
测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______ ![]() 填化学式
填化学式![]() 酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______
酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______ ![]() 填酸或碱
填酸或碱![]() 式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为______ .
(5)向FeSO4溶液中加入一定量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 ______ .