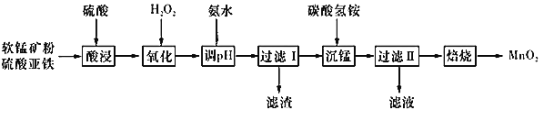
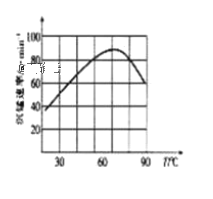
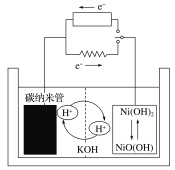
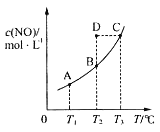
题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号: B__________,C __________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)E元素的正三价离子的电子排布式为____________________________________。
(5)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式____________________。
(6)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。
【答案】Na P HNO3 NaOH F F 1s22s22p63s23p63d5 SiO2 + 2OH-=SiO32- + H2O ![]() 泡利 洪特
泡利 洪特
【解析】
由A的原子结构示意图为:![]() ,可确定A为Si;B是同周期第一电离能最小的元素,则B为Na;C的最外层有三个成单电子,则其为P;从而得出D为N;E的外围电子排布式为3d64s2,则其为Fe。据此解答。
,可确定A为Si;B是同周期第一电离能最小的元素,则B为Na;C的最外层有三个成单电子,则其为P;从而得出D为N;E的外围电子排布式为3d64s2,则其为Fe。据此解答。
(1)由以上分析,可确定B为Na,C为P。答案为:Na;P;
(2)五种元素中,最高价氧化物对应水化物酸性最强的是HNO3,碱性最强的是NaOH。答案为:HNO3;NaOH;
(3)D为N,在第二周期,氮的第一电离能出现反常,大于非金属性比N强的O,但比F小,所以第一电离能最大的元素是F,电负性最大的元素是非金属性最强的F。答案为:F;F;
(4)E元素的正三价离子为Fe3+,核外电子数为23,由此可写出其电子排布式1s22s22p63s23p63d5。答案为:1s22s22p63s23p63d5;
(5)A的最高价氧化物为SiO2,B的最高价氧化物的水化物为NaOH,二者反应生成硅酸钠和水,反应的离子方程式为SiO2 + 2OH-=SiO32- + H2O;
(6)D为氮元素,其核外电子排布图为![]() ,这样排布遵循了泡利原理和洪特规则。答案为:
,这样排布遵循了泡利原理和洪特规则。答案为:![]() ;泡利;洪特。
;泡利;洪特。

 小题狂做系列答案
小题狂做系列答案【题目】实验室需配制0.2000molL﹣1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是_________(填字母),还缺少的玻璃仪器是_________(填仪器名称)。
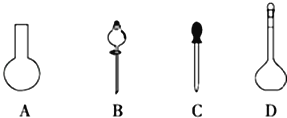
(2)根据计算需用天平称取Na2S2O3固体的质量是_________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_________(填“>”“<”或“=”,下同)0.2000molL﹣1.若还未等溶液冷却就定容了,则所得溶液浓度_________0.2000molL﹣1。
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000molL﹣1Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
①NaClO溶液中加入适量稀盐酸和足量KI固体时发生反应的离子方程式为_________。
②NaClO溶液的物质的量浓度是_________。
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
下列说法正确的是
容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 设k为该反应的化学平衡常数,则有k=k逆:k正
B. 达平衡时,容器Ⅱ与容器Ⅲ中的总压强之比为20∶17
C. 容器Ⅱ中起始平衡正向移动,达平衡时,容器Ⅱ中NO2的转化率比容器Ⅰ中的小
D. 若改变温度为T2,且T2>T1,则k正:k逆<0.8