题目内容
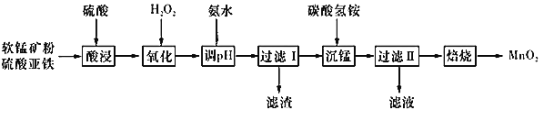
【题目】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于1×10-5mol·L-l时,可视为该金属离子已被沉淀完全。
(1)实验室预计需要使用480 mL 2 mol·L-1的硫酸,准备用18.4 mol·L-1的浓硫酸来配制,需用量筒量取浓硫酸________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_______。
(2)加入硫酸亚铁的原因为_____________________________。
(3)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_____________(用离子方程式表示)。“酸浸”时为加快反应速率可采取的措施是_____________________(至少写两个)。
(4)加入氨水应调节pH的范围为_______。“过滤II”所得滤渣为MnCO3,滤液中溶质的主要成分是_______(填化学式)
(5)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反应的离子方程式为_________。
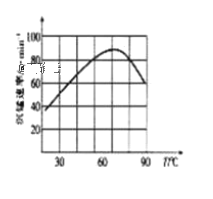
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_______。
【答案】54.0 500mL容量瓶、胶头滴管 将MnO2还原为MnSO4及酸浸时做催化剂 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 粉碎矿石、适当加热 4.68.1 (NH4)2SO4 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 温度过高时碳酸氢铵的分解速率显著加快,沉锰速率随碳酸氢铵浓度的减小而减慢
Mn2++Cl2↑+2H2O 粉碎矿石、适当加热 4.68.1 (NH4)2SO4 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 温度过高时碳酸氢铵的分解速率显著加快,沉锰速率随碳酸氢铵浓度的减小而减慢
【解析】
(1)实验室用18.4molL1的浓硫酸配制480mL 2molL1的硫酸,容量瓶规格是500mL,稀释前后硫酸的物质的量不变,据此计算浓硫酸体积;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还 500mL容量瓶、胶头滴管;
(2)软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)、硫酸亚铁先用稀硫酸酸浸,用双氧水将酸浸液中的亚铁离子氧化成铁离子,然后加入氨水调节溶液的pH使铁离子、铝离子转化成Al(OH)3、Fe(OH)3沉淀,过滤除去杂质,滤液中含有锰离子,向滤液中加入碳酸氢铵溶液得到MnCO3沉淀,过滤后得到MnCO3,滤液中只有含有(NH4)2SO4;MnCO3经过焙烧得到高纯MnO2,据此解答。
(1) 实验室用18.4molL1的浓硫酸配制480mL 2molL1的硫酸,容量瓶规格是500mL,稀释前后硫酸的物质的量不变,浓硫酸体积=2mol/L×0.5L÷18.4mol/L=54mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需500mL容量瓶、胶头滴管,500mL容量瓶配制溶液、胶头滴管定容,故答案为:54.0;500mL容量瓶、胶头滴管;
(2)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,且酸浸时硫酸亚铁作为催化剂,故答案为:将MnO2还原为MnSO4及酸浸时做催化剂;
(3)“酸浸”过程中不能用浓盐酸替代硫酸,因为二氧化锰会氧化浓盐酸,发生反应:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,将矿石粉碎与适当加热均可以加快反应速率,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,将矿石粉碎与适当加热均可以加快反应速率,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,粉碎矿石、适当加热;
Mn2++Cl2↑+2H2O,粉碎矿石、适当加热;
(4)常温下Al3+、Fe3+完全沉淀的pH分别为4.6、3.4,Mn2+开始沉淀的pH为8.1,所以加入氨水调节pH范围为4.68.1,“过滤”所得滤渣为MnCO3,滤液中溶质的主要成分是(NH4)2SO4,故答案为:4.68.1,(NH4)2SO4;
(5)①“沉锰”过程中锰离子与碳酸氢根离子反应生成碳酸锰沉淀,并放出CO2,该反应应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
②当温度高于60℃时,温度过高碳酸氢铵的分解速率显著加快,导致沉锰速率随碳酸氢铵浓度的减小而减慢,故答案为:温度过高时碳酸氢铵的分解速率显著加快,沉锰速率随碳酸氢铵浓度的减小而减慢。

 优学名师名题系列答案
优学名师名题系列答案