题目内容
15.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问题: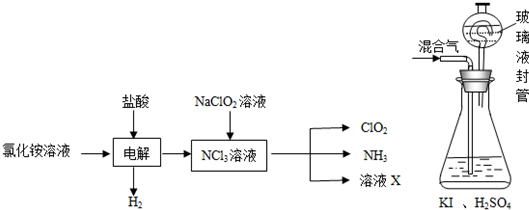
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2:1.
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑.
②溶液X中大量存在的阴离子有Cl-、OH-.
③除去ClO2中的NH3可选用的试剂是c(填标号).
a.水b.碱石灰C.浓硫酸d.饱和食盐水
(3)用上图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol•L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②玻璃液封装置的作用是吸收残余的二氧化氯气体(避免碘的逸出).
③V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内溶液颜色不再改变.
④测得混合气中ClO2的质量为0.02700 g..
(4)ClO2处理过的饮用水会含有一定最的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是d(填标号).
a.明矾b.碘化钾c.盐酸d.硫酸亚铁.
分析 本题在分析制ClO2的基础上,探究实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2,涉及氯化铵与盐酸混合溶液电解生成NCl3的原理及NCl3和NaClO2反应制ClO2的原理,以及反应后的混合物分离与提纯,另外还考查了利用滴定原理测定混合气体中ClO2的含量的基本操作要点及数据处理;
(1)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O;
(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-;由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②玻璃液封装置可防止有害气体逸出;
③淀粉遇碘单质变蓝;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
(4)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子.
解答 解:(1)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,故答案为:2:1;
(2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,故答案为:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
②在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,发生NCl3+NaClO2+H2O→ClO2+NH3+NaOH+NaCl,溶液X中大量存在的阴离子有Cl-、OH-,故答案为:Cl-、OH-.
③a.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故错误;
b.碱石灰不能吸收氨气,故错误;
c.浓硫酸可以吸收氨气,且不影响ClO2,故正确;
d.ClO2易溶于水,不能利用水吸收氨,故错误;
故答案为:c;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O,故答案为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
②玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出),故答案为:吸收残留的ClO2气体(避免碘的逸出);
③V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,故答案为:淀粉溶液,溶液由蓝色变为无色,且半分钟内不变色;
④含有Na2S2O3物质的量为0.02 L×0.1mol/L=0.002 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,
所以m(ClO2)=0.004 mol×67.5g/mol=0.02700g,故答案为:0.02700;
(4)若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,故答案为:d.
点评 本题考查物质含量的测定,为高频考点,为2015年高考真题,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.

| A. | NA个水分子在标准状况下的体积约为22.4L | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | H2SO4的摩尔质量就是NA个硫酸分子的总质量 | |
| D. | 在标准状况下,0.5NA个氯气分子所占的体积为11.2L |
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3+6OH--6e-=N2+6H2O.
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚.一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | a | b |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
(5)a=0.16
(6)下列说法中能说明该反应达到平衡状态的是BD.(填字母)
A.容器中压强不变 B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变 D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
则下列m与n的关系中,正确的是A(填字母).
A.n>2m B.m>2n C.2m>n D.m>3n.
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(2)比较此时正、逆反应速率的大小:v正>v逆,理由是浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反应向正反应进行.
(3)前5min时,用CH3OCH3表示该反应的速率为0.12mol/(L.min).
(4)再过一段时间后,反应达到平衡状态.能判断该反应已达到化学平衡状态的依据是B(填字母).
A.容器中压强不变 B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O) D.c(CH3OCH3)=c (H2O)
(5)达到平衡状态时,CH3OH的转化率97.6%(计算结果保留到小数点后1位).
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(一)制备1-溴丁烷粗产品:在下图装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O

(1)图1反应装置中加入沸石的目的是防止暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.
(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
| A. | 溶液是呈电中性的,而胶体是可以带电的 | |
| B. | 向沸水中加入FeCl3饱和溶液,继续煮沸至溶液呈红褐色时即得到Fe(OH)3胶体 | |
| C. | 清晨,阳光透过树叶间的缝隙可以产生丁达尔效应,说明空气是一种胶体 | |
| D. | 常用于区分溶液和胶体的方法是利用丁达尔效应,属于化学方法 |
| A. | NaCl水溶液 | B. | 盐酸 | C. | 铝 | D. | KOH固体 |
 在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示:
在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示: